लेखक: विनीता शिवकुमार एवं दीपशिखा चक्रवर्ती
अनुवाद: विवेक मेहता [Hindi PDF, 276 kB]
बायोफिल्म बैक्टीरिया में पाई जाने वाली एक तरह की जीवन शैली है। यह कोशिकाओं के बीच संवाद की एक जटिल प्रक्रिया है जिसके चलते कुछ खास तरह के जीन का नियमन होता है। इसका प्रभाव कोशिकाओं के बाहर बनने वाली मैट्रिक्स पर पड़ता है। यही मैट्रिक्स किसी बायोफिल्म की बुनियाद होती है। इस आलेख में हम बायोफिल्म के निर्माण की क्रियाविधि पर विस्तार से चर्चा करेंगे और बैक्टीरिया के लिए बायोफिल्म के कार्यिकीय महत्व को भी देखेंगे।
इस लेख का मकसद बायोफिल्म की एक बुनियादी समझ बनाना है। हमारे दाँतों पर जमी परत (प्लाक), मछलियों से भरे टैंक की दीवारों पर जमा लिसलिसा पदार्थ, जहाज़ों के ढाँचे पर नज़र आने वाली वृद्धि; ये सभी बायोफिल्म्स के उदाहरण हैं। बायोफिल्म असल में बैक्टीरिया का एक सुगठित समुदाय होता है जिसमें वे एक-दूसरे से और अन्य सतहों से चिपके रहते हैं। वैसे अनजाने में बायोफिल्म सदियों से देखी जाती रही हैं लेकिन इन पर अनुसन्धान हाल के कुछ वर्षों में ही तेज़ हुआ है। ऐतिहासिक रूप से, बायोफिल्म्स की सूक्ष्मजीव वैज्ञानिक जाँच का फोकस प्लवक (planktonic)) बैक्टीरिया और रोग पैदा करने की उनकी क्षमता के अध्ययन पर रहा है। हाल ही में, सूक्ष्मजीव विज्ञानी यह समझ पाए हैं कि बैक्टीरिया एककोशिकीय जीवन शैली के साथ-साथ बहुकोशिकीय शैली भी अपनाते हैं। बायोफिल्म इसी बहुकोशिकीय जीवन शैली की द्योतक है।
इस लेख के पहले भाग में बायोफिल्म से जुड़े अध्ययन के इतिहास पर नज़र डालेंगे। उसके बाद के दो भागों में हम देखेंगे कि बायोफिल्म के बनने की प्रक्रिया क्या होती है व क्या कारण है कि बैक्टीरिया ऐसी बायोफिल्म बनाते हैं। अन्त में, हम मानव जाति के लिए बायोफिल्म के फायदे और नुकसान पर विचार करेंगे।
बायोफिल्म अध्ययन का इतिहास
अधिकांश बैक्टीरिया बायोफिल्म नामक बहुकोशिकीय समुदाय बनाते हैं जो कोशिकाओं को पर्यावरण के खतरों से सुरक्षित रखते हैं। हालाँकि इन समुदायों को एन्तॉॅन फॉन लीवैनहुक ने काफी पहले 1684 में ही देख लिया था, लेकिन ‘बायोफिल्म’ शब्द का पहला इस्तेमाल सन् 1977 से मिलता है। और वैज्ञानिकों को इनका असली महत्व तो हाल ही में समझ आने लगा है।
बायोफिल्म का उल्लेख कथा-कहानियों में भी मिलता है। उदाहरण के तौर पर, लेखक जूल्स वर्न ने अपनी प्रसिद्ध किताब में ‘दूधिया समुद्र’ का उल्लेख किया है (देखें बॉक्स-1)।
|
बॉक्स - 1 Twenty Thousand Leagues Under the Sea |
वर्षों से नाविक ‘दूधिया समुद्र’ देखने का दावा करते आए हैं। जिस चीज़ को ‘दूधिया समुद्र’ कहा जाता है वह समुद्र में रात के समय प्रकट होने वाली, सभी दिशाओं में समान रूप से फैली, एक ऐसी तेज़ चमक होती है जो काफी देर तक बनी रहती है। डाइनोफ्लैजलेट1 व चमकदार बैक्टीरिया, दोनों ही इस घटना के सम्भावित कारण माने जाते थे। डाइनोफ्लैजलेट का दावा कमज़ोर था क्योंकि अव्वल तो ये क्षणिक रूप से प्रकाश छोड़ते हैं। इसके अलावा, ‘दूधिया समुद्र’ बहुत ही शान्त समुद्रों में भी देखे गए हैं जहाँ डाइनोफ्लैजलेट के होने की उम्मीद नहीं की जा सकती।
इस लिहाज़ से बैक्टीरिया बेहतर उम्मीदवार थे क्योंकि वे लगातार (हालाँकि कमज़ोर) चमक फेंकते हैं। लेकिन ज़्यादा अविश्वसनीय तो यह परिकल्पना थी कि इस घटना में बैक्टीरिया की भूमिका ऑॅटोइंडक्शन (स्व-प्रेरण) या कोरम-बोध की वजह से है। यह (कोरम-बोध) उद्दीपन और प्रतिक्रिया की एक व्यवस्था है जिस पर आगे विस्तार से चर्चा की गई है। यह दर्शाया गया कि प्लवक बैक्टीरिया आम तौर पर समुद्र में प्रकाश उत्सर्जित नहीं करते हालाँकि, प्रयोगशाला में कल्चर करने पर वे चमकदार होते हैं। लेकिन अगर बैक्टीरिया की एक कॉलोनी विकसित की जाए तो ऑटोइंड्यूसर (स्व-प्रेरक) की सान्द्रता में भी वृद्धि होगी जिसकी वजह से प्रकाश का उत्सर्जन होगा।
कोरम-बोध की खोज से नए अनुसन्धानों और खोजबीन का रास्ता खुल गया। अगर चमकदार समुद्र जैसी इतनी बड़ी घटना के पीछे ये सूक्ष्म बैक्टीरिया हो सकते हैं तो निश्चित रूप से खोजबीन करने के लिए कुछ-न-कुछ तो था।  बायोफिल्म्स कैसे पनपती हैं?
बायोफिल्म्स कैसे पनपती हैं?
किसी सूक्ष्म जीव के लिए, बायोफिल्म का हिस्सा होना एक सामुदायिक उद्यम है। बायोफिल्म एक त्रि-आयामी संरचना होती है जिसमें पानी की नलिकाएँ, exopolysaccharides, curli, डीएनए, पिलाई, फ्लैजेला, मलबा इत्यादि शामिल होते हैं। इनमें कई महत्वपूर्ण विशेषताएँ होती हैं - जैसे हानिकारक वातावरण से बचने के लिए अधिक प्रतिरोध, शारीरिक गुणधर्मों में लचीलापन व ऑटोइंड्यूसर की वजह से कोरम-बोध। तो सवाल उठता है कि ऐसी अद्भुत बायोफिल्म बनती कैसे हैं?
बायोफिल्म का निर्माण पाँंच चरणों में सम्पन्न होता है (देखें चित्र-1)।
अस्थाई जोड़
बायोफिल्म बनने की शुरुआत तब होती है जब मुक्त रहने वाले प्लवक सूक्ष्मजीव किसी सतह से चिपकते हैं। सतह के पास के ये बैक्टीरिया दो अलग-अलग तरह के बलों का अनुभव करते हैं - वान-डर-वाल्स आकर्षण बल व कुल नकारात्मक इलेक्ट्रोस्टेटिक प्रतिकर्षण बल। किसी बाहरी कारण से गतिज ऊर्जा में बढ़ोतरी हो तो इस बात की सम्भावना बढ़ जाती है कि बैक्टीरिया प्रतिकर्षण बल से पार पा कर सतह के साथ भौतिक सम्पर्क में आ जाएँगे। सतह के साथ यह सम्पर्क उनकी सतह पर मौजूद पिलाई, फ्लैजेला जैसे ग्राहियों तथा कई चिपकने वाले अणुओं के माध्यम से होता है। कुछ जीव सीधे सतह से नहीं चिपक पाते। ऐसे में वे उन सूक्ष्मजीवों से ही चिपक लेते हैं जो पहले ही सतह पर कब्ज़ा जमा चुके हैं।
स्थाई जोड़
अमूमन कोशिकाओं के ऊपर अपने ही द्वारा बनाई गई एक तरह की पॉलिमर से बनी संरचना का आवरण होता है, जिस वजह से मैट्रिक्स के साथ एक स्थाई जुड़ाव बनता है।
परिपक्वता 1 व 2
एक दफे सूक्ष्म कॉलोनी स्थापित होने के बाद कोशिका विभाजन व बाहर से आकर कोशिकाओं के जुड़ने जैसी प्रक्रियाओं के चलते इसके आकार व मात्रा में बढ़ोतरी होती रहती है।
बिखराव (डिस्पर्सल)
बायोफिल्म्स का जीवनकाल सीमित होता है। इसके कारणों में पोषक तत्वों की कमी व जैविक व पर्यावरणीय कारक होते हैं - जैसे आसपास के कणों के घर्षण व तरल दबाव (fluid shear))। इस बात के सबूत लगातार बढ़ रहे हैं कि बायोफिल्म्स अपने बिखराव की शुरुआत स्वयं ही करती हैं। कई प्रयोगशालाओं ने सीडिंग डिस्पर्सल का विवरण दिया है जिसमें बायोफिल्म का आन्तरिक भाग गलने लगता है जबकि बाहरी हिस्सा टूटने लगता है। इसके परिणामस्वरूप प्लवक बैक्टीरिया कॉलोनी से अलग हो जाते हैं व अपने पीछे एक खाली कॉलोनी छोड़ जाते हैं। आम तौर पर बिखराव की इस प्रक्रिया के साथ-साथ ही विलगन भी होने लगता है।2
बायोफिल्म के विकास व बिखराव को प्रभावित करने वाले कारक
बायोफिल्म का बिखराव पोषक तत्वों की कमी, ऑक्सीजन में कमी व तापमान में बदलाव जैसे पर्यावरणीय कारणों से नज़दीकी से जुड़ा है। बिखराव के लिए ज़रूरी है कि बैक्टीरिया अपनी ‘खोल’ को तोड़ डालें। ऐसा करने के लिए बायोफिल्म में एंज़ाइम और सतह-सक्रिय पदार्थ जैसे नाना प्रकार के कारक विकसित होते हैं। बैक्टीरिया-भक्षी वायरस भी बायोफिल्म की मैट्रिक्स, DNA, शर्कराओं और प्रोटीन के क्षय में मदद करते हैं, जिसके चलते अन्तत: बायोफिल्म बिखर जाती है।
इसके अलावा, प्राकृतवास के क्षय की वजह से उत्पन्न तनाव भी बिखराव की प्रक्रिया को शुरू करने में काफी बड़ी भूमिका निभाता है। बिखराव के ज़रिए जो विविध कोशिकाएँ आकर जुड़ती हैं उनसे बनी बायोफिल्म्स की बदौलत उन प्राकृतवासों की संख्या काफी बढ़ जाती है जहाँ ये कोशिकाएँ बस सकती हैं
|
बॉक्स - 2
|
यह शैली ही क्यों?
एकता में ही शक्ति है। इस सूत्र-वाक्य का इस्तेमाल मनुष्यों ने सफलता-पूर्वक किया है; चाहे सेना में, परिवार में या देशों के मामले में। प्रकृति में भी मछलियों, पक्षियों व कीटों जैसे सामुदायिक प्राणियों के लिए भी यही दर्शन लागू होता है। यही रणनीति सबसे सरल जीवों में भी पाई गई है। 19वीं सदी से ही हम यह जानते हैं कि कई तरह के एककोशिकीय जीवों ने इस सिद्धान्त का इस्तेमाल कर अत्याधिक परिष्कृत कॉलोनियाँ बनाई हैं ताकि कई अलग-अलग तरह के वातावरण में जीवित रहा जा सके। ऐसी अटकलें लगाई गई हैं कि बैक्टीरिया अपनी वृद्धि के लिए प्रमुख रूप से बायोफिल्म का इस्तेमाल करते हैं। ऐसा माना जाता है कि बायोफिल्म प्रतिकूल परिस्थितियों के खिलाफ जैव-विकास का गौण उत्पाद है। अपनी संरचनात्मक कार्यक्षमता और विविधता के मामले में बायोफिल्म उच्चतर जीवों के समतुल्य हैं। किसी बायोफिल्म में रह रहे बैक्टीरिया के गुण उनके मुक्त प्लवक समकक्षों से काफी अलग होते हैं।
बायोफिल्म की मुख्य विशेषताएँ
कोरम-बोध
1970 के दशक से वैज्ञानिकों ने एक अनोखी घटना का वर्णन करना शु डिग्री किया था। वे विब्रियो फिशराय (Vibrio fischeri) नामक बैक्टीरिया में जैव-दीप्ति की जाँच कर रहे थे। सूक्ष्मजीव वैज्ञानिक इस बात को लेकर उलझन में थे कि जब जनसंख्या घनत्व कम होता है तब ये बैक्टीरिया प्रकाश उत्पादन नहीं करते। जैसे-जैसे बैक्टीरिया के समुदाय में बढ़ोतरी होती है, कोशिकाओं का ‘स्विच ऑॅन’ हो जाता है। संख्या के घटने या बढ़ने के साथ कोशिकाओं द्वारा अपने जीन्स को ‘ऑॅफ या ऑॅन’ करने की क्षमता को कोरम-बोध का नाम दिया गया। जाँचकर्ताओं का निष्कर्ष था कि विब्रियो एक पदार्थ का उत्पादन करता है जिसकी सान्द्रता एक सीमा से ज़्यादा हो जाए, तो वह एंज़ाइम ल्यूसीफरेस को प्रकाश उत्सर्जित करने के लिए उकसाता है। उक्त पदार्थ को उन्होंने ऑटोइंड्यूसर ‘A1’ नाम दिया। इस पहले अवलोकन के बाद देखा गया कि कोरम-बोध या ऑटोइंड्यूसर व्यापक रूप से पाया जाता है व कई महत्वपूर्ण कार्यों के लिए ज़िम्मेदार है। बायोफिल्म को वैकासिक अनुकूलन मुख्यत: कोरम-बोध की वजह से ही माना जाता है जिसके चलते बैक्टीरिया अलग-अलग तरह की व्यवहार-शैलियाँ अपना सकते हैं व कोशिकाओं के बीच सम्प्रेेषण सम्भव हो पाता है।
स्यूडोमोनास एरुजिनोसा (seudo- monas aeruginosa)वह बैक्टीरिया है जिसके कोरम-बोध तंत्र को काफी अच्छे से समझा गया है। पौधों व जन्तुुओं, जिनमें इन्सान भी शामिल हैं, में इस बैक्टीरिया के उग्र संक्रमण का मुख्य कारण कोरम-बोध ही है। कोरम-बोध ही बायोफिल्म के विकास, गतिशीलता और ऐसे विषाक्त पदार्थों के निर्माण का नियंत्रण करता है जो व्यापक तौर पर ऊतकों को नुकसान पहुँचा सकते हैं व रक्त-प्रवाह में प्रविष्ट हो सकते हैं।
आम तौर पर ऐसा माना जाता है कि कोरम-बोध जीन्स की अभिव्यक्ति को सुगम बनाता है। यह भी पता चला है कि कोरम-बोध - प्रजाति की बाधाओं3 को पार कर सकता है - इस मायने में कि ये सन्देशवाहक अणु यूकेरियोट (वनस्पति और जन्तुु, दोनों) के व्यवहार को प्रभावित करते हैं व आसपास के पर्यावरण को प्रभावित कर बायोफिल्म के अस्तित्व को बचाए रखने में भूमिका निभा सकते हैं। इस तरह के अन्तर-प्रजाति सम्प्रेषण का काफी महत्व है क्योंकि बैक्टीरिया अमूमन कई प्रजातियों के मिले-जुले समूहों में रहते हैं। कोरम बोध के क्षेत्र में होने वाले अनुसन्धान के कई सम्भावित उपयोग हैं और ज़्यादातर अनुसन्धान बायोफिल्म के सन्देश-तंत्र में हस्तक्षेप करने से सम्बन्धित हैं ताकि बैक्टीरिया को नियंत्रित किया जा सके। ऐसे उत्परिवर्तित रूप (म्यूटेन्ट) पाए जा चुके हैं जो कोरम नियंत्रित कारकों के उत्पादन का लाभ लेते हैं।
प्रतिरोध
अपने घटक सदस्यों की तुलना में बायोफिल्म की कोशिकाएँ ज़्यादा प्रतिरोध प्रदान करती हैं। इस तरह की बायोफिल्म कोशिकाएँ कई तरह के रोगों को जन्म दे सकती हैं। सूक्ष्मजीवी बायोफिल्म हानिकारक होती हैं और अस्पतालों और उद्योगों में ये अवांछित होती हैं लेकिन इनका उन्मूलन एक बड़ी समस्या है। प्रमुख तौर पर बायोफिल्म पर्यावरण के पोषक तत्वों पर कब्ज़ा करने व सुरक्षा प्रदान करने का काम करती हैं। यह देखा गया है कि बायोफिल्म कोशिकाएँ जीवाणुरोधी पदार्थों और सफाई करने वाले पदार्थों के खिलाफ अधिक-से-अधिक प्रतिरोध दर्शाती हैं। साल्मोनेला टाइफिम्यूरियम (Salmonella typhimurium) ऐसी बायोफिल्म बनाने में सक्षम हैं जो मेज़बान की प्रतिरक्षा कोशिकाओं से उनकी रक्षा करती हैं।
विसरण
विसरण ही बायोफिल्म में आणविक आवा-जाही का प्राथमिक साधन है। कोरम-बोध एसाइल होमोसेरीन लैक्टोन्स (AHL) द्वारा किया जाता है। ये तेज़ी से विसरित होने वाले ऐसे यौगिक होते हैं जो प्लाज़्मा झिल्ली को पार करके बाह्य वातावरण में जा सकते हैं। जब सान्द्रता एक सीमा से ज़्यादा हो जाती है तब ये अणु एक रेगुलेटर (नियंत्रक) के माध्यम से आरएनए पोलीमरेज़ एंज़ाइम से जुड़ जाते हैं। पोषक तत्वों का परिवहन भी विसरण के ज़रिए ही होता है। बायोफिल्म का विकास व कामकाज वातावरण से प्राप्त पोषक तत्वों पर ही निर्भर करता है। तरल परिवहन चैनलों के चलते भी आवागमन की प्रक्रिया में तेज़ी आती है।
बायोफिल्म: वरदान या अभिशाप
उपयोगी बायोफिल्म
कई बायोफिल्म इकॉलॉजी में एक प्रमुख भूमिका निभाती हैं। बायोफिल्म की लाभकारी भूमिका का सबसे बढ़िया उदाहरण अपशिष्ट पानी के उपचार व सफाई में इनका उपयोग है। पानी को छानने के कुछ तरीकों में छन्नी एक ऐसी सतह का काम देती है जिस पर सूक्ष्म जीव चिपक जाते हैं और पानी में उपलब्ध कार्बनिक पदार्थों को चट कर जाते हैं। बायोफिल्म द्वारा अपशिष्ट पानी काफी प्रभावशाली रूप से साफ होता है।
दुर्घटना की वजह से जहाँ टेंकर से गिरे तेल के कारण समुद्र प्रदूषित होते हैं वहाँ बायोफिल्म का इस्तेमाल पेट्रोलियम और अन्य तेल उत्पादों को ‘खाने’ के लिए भी किया जा सकता है। माइक्रोबियल धुलाई भी एक तरीका है। उदाहरण के तौर पर, कम ग्रेड के अयस्क की हल्के अम्ल से क्रिया कराई जाती है ताकि बैक्टीरिया के विकास को प्रोत्साहन मिले। ये बैक्टीरिया अयस्क को ऑॅक्सीकृत करते हैं जिससे ताँबे के ऑॅक्सीकृत (क्यूप्रिक) आयन मिल जाते हैं। लेकिन इन्सानों के लिए सबसे प्रभावशाली व महत्वपूर्ण बायो-फिल्म है - आँतों का सूक्ष्मजीव संसार4। हमारी आँतों में जीवाणुओं की अनगिनत किस्में होती हैं। इनके चलते हमें कुछ ऐसी आनुवंशिक और चयापचयी विशेषताएँ हासिल हो जाती हैं जिन्हें हमने अपने दम पर हासिल नहीं किया है। हमारे हमसफर इन सूक्ष्मजीवी टुकड़ियों के सह-विकास पर कई अध्ययन हो चुके हैं। हमारी आँत के सूक्ष्म संसार की संरचना को देखकर पता चलता है कि मेज़बान (यानी इन्सान) व सूक्ष्मजीवों, दोनों ही के स्तर पर प्राकृतिक चयन की प्रक्रिया काम करती है।
आँतों के सूक्ष्मजीव क्षमतानुरूप काम न करें तो मेज़बान की फिटनेस (प्रजनन व ज़िन्दा रहने की क्षमता) में कमी आ जाती है। कई तरह की संक्रामक बीमारियाँ आँतों से सम्बन्धित होती हैं और ‘अच्छे’ सूक्ष्मजीव ‘बुरे’ रोगजनक सूक्ष्मजीवों को हमसे दूर रखने में मदद करते हैं। विकसित देश आँत सम्बन्धी रोगों पर कड़ा नियंत्रण रखते हैं, फिर भी एलर्जी और शोथ जैसी तकलीफें बहुत आम हैं। ऐसा माना जाता है कि आँतों में उपयुक्त सूक्ष्मजीव संसार न हो तो बैक्टीरिया व प्रतिरक्षा प्रणाली के बीच का सन्तुलन बिगड़ जाता है।
आँतों में सामान्य सूक्ष्मजीव संसार विटामिनों का संश्लेषण व स्रवण करता है, रोगाणुओं को आँतों में घर बनाने से रोकता है, ऊतकों के विकास व एन्टीबॉडी के उत्पादन में मदद करता है।
बैक्टीरिया का एक अन्य सम्भावित उपयोग कैंसर के इलाज में है। बैक्टीरिया की कई प्रजातियाँ बसने के लिए कैंसर ऊतकों को ज़्यादा पसन्द करती हैं। ठोस ट्यूमर की एक खासियत होती है कि वे कम ऑॅक्सीजन वाले क्षेत्रों में पाए जाते हैं। कुछ अनॉक्सी बैक्टीरिया ऐसे क्षेत्रों की ही तलाश में रहते हैं। वहाँ वे ट्यूमर पर बस जाते हैं, सामान्य ऊतकों को अछूता छोड़ देते हैं। ट्यूमर पर इस तरह की बसाहट के चलते ट्यूमर का विकास रुक सकता है या वह पूरी तरह गायब भी हो सकती है।
हानिकारक बायोफिल्म्स
बायोफिल्म बहुत हानिकारक भी हो सकती हैं। अपनी प्रतिरोधक क्षमता के चलते, ये कई अनचाही जगहों पर भी बन जाती हैं और संक्रमण का कारण बनती हैं। जैसे साल्मोनेला द्वारा निर्मित बायोफिल्म खाद्य प्रोसेसिंग इकाइयों में परेशानी का सबब होती हैं। बायोफिल्म में पाए जाने वाले बैक्टीरिया अपने प्लवक समकक्षों की तुलना में एन्टीबायोटिक दवाओं के खिलाफ 1000 गुना ज़्यादा प्रतिरोधी हैं। ऐसी बायोफिल्म भोजन के सन्दूषण का एक स्रोत रही हैं। दवाखानों में इनके चलते गम्भीर समस्याएँ पैदा हो सकती हैं। अक्सर ही ऐसी नलिकाएँ (केथेटर्स) जिन्हें मरीज़ों के शरीर के अन्दर डाला जाता है बायोफिल्म बनने के चलते प्रदूषित हो सकती हैं। ऐसी बायोफिल्म जीर्ण व जानलेवा संक्रमण (sepsis) को जन्म दे सकती हैं। ऐसा होने पर केथेटर को हटाना ही एकमात्र समाधान होता है जो असुविधाजनक और दर्दनाक प्रक्रिया है। S. aureus अस्पतालों में होने वाले संक्रमणों का एक प्रमुख कारण है। वजह इसकी बायोफिल्म बनाने की क्षमता है।
बायोफिल्म को बनने से रोकने व उन्हें नष्ट करने की दिशा में अनुसन्धान की आवश्यकता है। ICU में होने वाले कुछ अन्य आम संक्रमण हैं श्वास नली में लगाई जाने वाली ट्यूब की सतह पर बायोफिल्म का बनना, मूत्र मार्ग में संक्रमण इत्यादि। एक अनुमान के मुताबिक रक्त प्रवाह में लगभग 90 प्रतिशत अस्पताल-जनित संक्रमण बड़ी शिराओं में लगाए जाने वाले केथेटर्स की वजह से होते हैं।
बायोफिल्म से जुड़ा एक अन्य गौरतलब पहलू यह है कि वे अपने मेज़बान को बीमारी का वाहक बना देती हैं (मतलब सम्बन्धित व्यक्ति में बैक्टीरिया तो पाए जाते हैं, मगर रोग के लक्षण प्रकट नहीं होते)। विशेष तौर से, almonella enterica serovars typhi से संक्रमित 3% से 5% लोग स्थाई रोग-वाहक बन जाते हैं। साल्मोनेला संक्रमण खराब हाईजीन वाले क्षेत्रों में केन्द्रित होता है जहाँं मल-सन्दूषित पदार्थ ग्रहण किए जाते हैं जो रोगाणुयुक्त होते हैं। कुछ लोग पित्ताशय की थैली के निरन्तर संक्रमण के शिकार हो जाते हैं और इन्हें रोग-वाहक कहते हैं। ऐसा दिखलाया गया है कि साल्मोनेला पित्त की पथरी पर बायोफिल्म का निर्माण करने में सक्षम होता है व लम्बी अवधी तक जीवित रह सकता है। इसका सबसे प्रसिद्ध उदाहरण हैं ‘टायफॉइड मैरी’5, जिनमें बाहरी तौर पर तो बीमारी के कोई लक्षण नहीं थे लेकिन फिर भी वे अपने आस पास के लोगों को संक्रमित कर गईं।
बायोफिल्म्स पर नियंत्रण
कई लोगों ने बायोफिल्म को लेकर लगभग एक-सी चिन्ताएँ व्यक्त की हैं - बायोफिल्म की पहचान व नियंत्रण। प्रश्न यह है कि बायोफिल्म की संरचनाओं को कैसे समाप्त किया जाए। सबसे अच्छा जवाब प्राकृतिक क्रिया-विधियों से मिलता है। अब यह समझ में आने लगा है कि जन्तु व वनस्पति अपनी उत्पत्ति के समय से ही बायोफिल्म का सामना करते रहे हैं। उदाहरण के तौर पर, कुछ जन्तु म्यूसिन पॉलिमर की मदद से बायोफिल्म के निर्माण को रोकते हैं।
 ब्रोमिनेटेड फ्यूरेनोन्स कोरम-बोध को बाधित करने के लिए जाने जाते हैं। इसी कारण से इनका इस्तेमाल बायोफिल्म से लड़ने में होता है। हानिकारक बायोफिल्म से लड़ने के लिए बैक्टीरियाभक्षी वायरसों के इस्तेमाल की दिशा में भी अनुसन्धान जारी है। बैक्टीरियाभक्षी वायरस बायोफिल्म को भेदने में सक्षम होते हैं, लेकिन उन्हें पहले बायोफिल्म के वायरस-सुरक्षा कवच को तोड़ना होता है। वैसे बायोफिल्म के खिलाफ बैक्टीरियाभक्षी वायरस के इस्तेमाल की बात कितनी ही आशाजनक प्रतीत क्यों न हो, ऐसा करने में एकीकरण (ntegration) से जुड़े कई जोखिम शामिल हैं जिनके चलते इस रणनीति की सम्भावना कम ही बनती है। बायोफिल्म को खत्म करने के लिए ज़रूरी है कि सम्बन्धित बैक्टीरिया की पहचान की जाए व उपलब्ध उपायों में से सबसे उपयुक्त का चयन किया जाए जो उसी बैक्टीरिया किस्म के लिए बना हो।
ब्रोमिनेटेड फ्यूरेनोन्स कोरम-बोध को बाधित करने के लिए जाने जाते हैं। इसी कारण से इनका इस्तेमाल बायोफिल्म से लड़ने में होता है। हानिकारक बायोफिल्म से लड़ने के लिए बैक्टीरियाभक्षी वायरसों के इस्तेमाल की दिशा में भी अनुसन्धान जारी है। बैक्टीरियाभक्षी वायरस बायोफिल्म को भेदने में सक्षम होते हैं, लेकिन उन्हें पहले बायोफिल्म के वायरस-सुरक्षा कवच को तोड़ना होता है। वैसे बायोफिल्म के खिलाफ बैक्टीरियाभक्षी वायरस के इस्तेमाल की बात कितनी ही आशाजनक प्रतीत क्यों न हो, ऐसा करने में एकीकरण (ntegration) से जुड़े कई जोखिम शामिल हैं जिनके चलते इस रणनीति की सम्भावना कम ही बनती है। बायोफिल्म को खत्म करने के लिए ज़रूरी है कि सम्बन्धित बैक्टीरिया की पहचान की जाए व उपलब्ध उपायों में से सबसे उपयुक्त का चयन किया जाए जो उसी बैक्टीरिया किस्म के लिए बना हो।
बायोफिल्म एन्टीबायोटिक दवाओं के खिलाफ प्रतिरोध पैदा करती हैं। यह कैसे होता है? हालाँकि कुछ लोगों का मत है कि एन्टीबायोटिक बायोफिल्म को भेद नहीं सकतीं, लेकिन ज़्यादातर मामलों में यह दावा गलत साबित हुआ है। किम लेविस के अनुसार छोटे सूक्ष्मजीवरोधी अणुओं से सम्बन्धित ज़्यादातर मामलों में, polysaccharide मैट्रिक्स की बाधा कोशिकाओं की रक्षा नहीं करती, उनकी मौत को टालती भर है। लेकिन, बायोफिल्म को भेदने के बाद भी ज़िद्दी कहलाने वाली कई कोशिकाएँ बची रह जाती हैं। जैसा कि नाम से ही ज़ाहिर है, ज़िद्दी कोशिकाएँ वे होती हैं जो एन्टीबायोटिक दवाओं के शुरुआती हमलों से बचने में कामयाब हो जाती हैं। अगर उन्हें अनियंत्रित छोड़ दिया जाए तो वे दोबारा बायोफिल्म बना सकती हैं। इसलिए, एन्टीबायोटिक दवाओं के लम्बे समय तक सेवन से बायोफिल्म का पूरी तरह उन्मूलन सम्भव है। इसके अलावा, यह भी पता चला है कि P. aeruginosa कुछ विशिष्ट जीन को अभिव्यक्त करके एन्टीबायोटिक के प्रहार को सहने की क्षमता सिर्फ अपने बायोफिल्म अवतार में ही दर्शाता है।
 बायोफिल्म एक सच्चाई है। चाहे अंटार्कटिका का बर्फीला रेगिस्तान हो, समुद्र की गहराइयाँ हों, भूमिगत चट्टानों की दरारें हों, या बरसाती जंगल या हमारा अपना शरीर ही क्यों न हो, बायोफिल्म सर्वव्यापी हैं। अब ऐसा लगने लगा है कि बायोफिल्म का इस्तेमाल कर कई घटनाओं को समझा जा सकता है। एक अनुमान के मुताबिक धरती पर मौजूद आधे से अधिक बायोमास (जैविक सामग्री) बायोफिल्म से ही बना हुआ है। यहाँ तक कि बायोफिल्म जीवाश्म रूप में भी पाए गए हैं जो दर्शाता है कि ये धरती के शुरुआती निवासियों में से हैं।
बायोफिल्म एक सच्चाई है। चाहे अंटार्कटिका का बर्फीला रेगिस्तान हो, समुद्र की गहराइयाँ हों, भूमिगत चट्टानों की दरारें हों, या बरसाती जंगल या हमारा अपना शरीर ही क्यों न हो, बायोफिल्म सर्वव्यापी हैं। अब ऐसा लगने लगा है कि बायोफिल्म का इस्तेमाल कर कई घटनाओं को समझा जा सकता है। एक अनुमान के मुताबिक धरती पर मौजूद आधे से अधिक बायोमास (जैविक सामग्री) बायोफिल्म से ही बना हुआ है। यहाँ तक कि बायोफिल्म जीवाश्म रूप में भी पाए गए हैं जो दर्शाता है कि ये धरती के शुरुआती निवासियों में से हैं।
यह अवधारणा अब बासी पड़ चुकी है कि बैक्टीरिया सिर्फ एककोशिकीय रूप में ही पाए जाते हैं। कोशिकाओं के ऐसे कार्यात्मक व संरचनात्मक दृष्टि से उन्नत समुदाय मिलते हैं जिनमें वातावरण को प्रभावित करने की क्षमता होती है। इसलिए यह ज़रूरी है कि हम सभी को यह जानकारी हो कि बायोफिल्म हमारे जीवन में कैसी भूमिका निभाते हैं तथा कैसे लाभकारी होने के साथ-साथ हानिकारक भी हैं। मूल कारण को समझे बिना किसी भी समस्या का समाधान असम्भव है।
विनीता शिवकुमार: बेंगलूरु के नैशनल पब्लिक स्कूल में 12वीं में पढ़ रही हैं और पिछली गर्मियों में दीपशिखा चक्रवर्ती की प्रयोगशाला में ये समर ट्रेनी रहीं।
दीपशिखा चक्रवर्ती: भारतीय विज्ञान संस्थान, बेंगलूरु के डिपार्टमेंट ऑफ माइक्रोबायोलॉजी एण्ड सैल बायोलॉजी में असिसटेंट प्रोफेसर हैं। इनकी प्रयोगशाला में शोधकर्ताओं को मेज़बान-रोगजनक की पारस्परिक क्रियाओं (host-pathogen interactions) और रोगजनकों के ज़िन्दा रहने की रणनीतियों को समझने में रुचि है।
अनुवाद: विवेक मेहता: आई.आई.टी., कानपुर से मेकेनिकल इंजीनियरिंग में पीएच.डी. की है। इन दिनों स्वतंत्र रूप से लिखने व अनुवाद का काम करते हैं।
यह लेख रेज़ोनेंस पत्रिका के अंक नवम्बर, 2014 से लिया गया है।
सन्दर्भों की पूरी सूची आपको इस लिंक पर मूल लेख में मिल जाएगी: http://www.ias.ac.in/resonance/Volumes/19/11/1005-1016.pdf
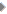


 शाम के सात बजे, नॉटिलस एक दूधिया-समुद्र में आधा डूबा हुआ आगे बढ़ा जा रहा था। क्या यह चाँद की किरणों का असर था? ऐसा नहीं हो सकता। यह तो महज़ दूज का चाँद है जो अब भी सूरज की किरणों के प्रभाव में क्षितिज में दुबका है। हालाँकि आकाश में चमकीली रोशनी फैली हुई है लेकिन समुद्री दूधिया पानी की तुलना में आकाश काला ही प्रतीत हो रहा था।
शाम के सात बजे, नॉटिलस एक दूधिया-समुद्र में आधा डूबा हुआ आगे बढ़ा जा रहा था। क्या यह चाँद की किरणों का असर था? ऐसा नहीं हो सकता। यह तो महज़ दूज का चाँद है जो अब भी सूरज की किरणों के प्रभाव में क्षितिज में दुबका है। हालाँकि आकाश में चमकीली रोशनी फैली हुई है लेकिन समुद्री दूधिया पानी की तुलना में आकाश काला ही प्रतीत हो रहा था।  इस चित्र में हमारे दाँतों पर जमने वाली बायोफिल्म दिखलाई गई है। दाँतों पर इस मोटी परत के जमने के कई चरण होते हैं और उनकी शुरुआत होती है दाँतों पर एक पतली झिल्ली के बनने से और अन्त होता है एक परिपक्व बायोफिल्म के निर्माण के साथ। यह परत दरारों, चिकनी सतहों व मसड़ों की दरारों वगैरह पर जमी होती हैं। लेकिन अपनी परिपक्व अवस्था में यह उन जगहों पर ज़्यादा पाई जाती है जो टूथब्रश जैसी बाहरी ताकतों के प्रभाव से बची रह सकती हैं, जैसे कि दाँतों व मसूड़ों की दरारें। दाँतों पर जमी बायोफिल्म के विकास के पीछे दो प्रक्रियाएँ ज़िम्मेदार होती हैं: बाहर से सूक्ष्म जीवों का आकर जुड़ना व कोशिका-विभाजन। दाँतों की बायोफिल्म की कोशिकाएँ भी एक खास क्रम में ही जमती हैं।
इस चित्र में हमारे दाँतों पर जमने वाली बायोफिल्म दिखलाई गई है। दाँतों पर इस मोटी परत के जमने के कई चरण होते हैं और उनकी शुरुआत होती है दाँतों पर एक पतली झिल्ली के बनने से और अन्त होता है एक परिपक्व बायोफिल्म के निर्माण के साथ। यह परत दरारों, चिकनी सतहों व मसड़ों की दरारों वगैरह पर जमी होती हैं। लेकिन अपनी परिपक्व अवस्था में यह उन जगहों पर ज़्यादा पाई जाती है जो टूथब्रश जैसी बाहरी ताकतों के प्रभाव से बची रह सकती हैं, जैसे कि दाँतों व मसूड़ों की दरारें। दाँतों पर जमी बायोफिल्म के विकास के पीछे दो प्रक्रियाएँ ज़िम्मेदार होती हैं: बाहर से सूक्ष्म जीवों का आकर जुड़ना व कोशिका-विभाजन। दाँतों की बायोफिल्म की कोशिकाएँ भी एक खास क्रम में ही जमती हैं।