सुशील जोशी
 परमाणुओं के बीच इलेक्ट्रॉनों की थ साझेदारी से जब अणु बनते हैं तो उसे सहसंयोजी बंधन या सहबंध कहते हैं। आयनिक बंध के ' मामले में हमने देखा था कि एक तत्व अपना इलेक्ट्रॉन त्याग देता है और दूसरा तत्व उसे ग्रहण कर लेता है। इस प्रकार से धनायन व ऋणायन बनते हैं। इनके बीच परस्पर आकर्षण इस व्यवस्था को स्थायित्व प्रदान करता है। यहां हम यह देखने की कोशिश करेंगे। कि ‘सहबंध व्यवस्था को स्थायित्व कैसे मिलता है। इसे समझने के लिए प्रायः दो अलग-अलग मॉडलों का इस्तेमाल किया जाता है:
परमाणुओं के बीच इलेक्ट्रॉनों की थ साझेदारी से जब अणु बनते हैं तो उसे सहसंयोजी बंधन या सहबंध कहते हैं। आयनिक बंध के ' मामले में हमने देखा था कि एक तत्व अपना इलेक्ट्रॉन त्याग देता है और दूसरा तत्व उसे ग्रहण कर लेता है। इस प्रकार से धनायन व ऋणायन बनते हैं। इनके बीच परस्पर आकर्षण इस व्यवस्था को स्थायित्व प्रदान करता है। यहां हम यह देखने की कोशिश करेंगे। कि ‘सहबंध व्यवस्था को स्थायित्व कैसे मिलता है। इसे समझने के लिए प्रायः दो अलग-अलग मॉडलों का इस्तेमाल किया जाता है:
- संयोजी बन्धन मॉडल या सिद्धांत (Valence Bond Theory)
- आण्विक कक्षक मॉडल या सिद्धांत (Molecular Orbital Theory)
ये दोनों ही सिद्धांत क्वांटम यांत्रिकी के सिांतों पर आधारित है।
क्या है कक्षक
यहां प्रस्तुत मॉडलों में कई किस्म के भ्रम होने की संभावना है। मसलन बोर ने परमाणु संरचना के संदर्भ में इलेक्ट्रॉन कक्षा की अवधारणा प्रस्तुत की थी। मान्यता यह थी कि इलेक्ट्रॉन इस कक्षा के मार्ग पर केन्द्रक के इर्द गिर्द अमण करता है। परन्तु आगे चलकर कक्षक ( ऑर्बिटल ) की अवधारणा विकसित हुई। विभिन्न कक्षकों के चित्र भी किताबों में मिल जाएंगे। दरअसल कक्षक एक गणितीय अवधारणा है। यह तो आप जानते ही होंगे कि प्रत्येक कण के साथ एक तरंग संबद्ध होती है। कक्षक वास्तव में इस तरंग का तरंग फलन (Wave function) हैं। इसका वर्ग हमें इलेक्ट्रॉन के पाए जाने की सम्भाविता का आभास देता है। इस सम्भाविता को इलेक्ट्रॉन घनत्व के रूप में या समघनत्व रेखाओं (कन्टूर) के रूप में प्रदर्शित किया जाता है। कक्षक किसी तरंग समीकरण की मात्र चित्रात्मक प्रस्तुति भर है।
यह भी ध्यान रखना होगा कि इलेक्ट्रॉन घनत्व के सारे चित्र एक त्रि-आयामी स्थान की दो-आयामी प्रस्तुती हैं।
लिहाजा इनमें इलेक्ट्रॉन को मूलतः एक तरंग द्वारा दर्शाया जाता है तथा सारी गणनाएं व परिकल्पनाएं तरंग समीकरणों के आधार पर की जाती हैं। इनमें निश्चित रूप से काफी सारा गणित शामिल होता है। मैं इस गणित से बचना चाहूंगा। पहला कारण यह है कि उससे बातचीत बहुत बोझिल व पेचीदा हो जाएगी। दूसरा कारण यह है कि गणित मुझे आता नहीं है।
फर्क दोनों मॉडल में
दोनों ही सिद्धांत' कई किस्म के लगभगीकरण और सरलीकरण पर टिके हैं। इलेक्ट्रॉन तरंगों की सरलतम समीकरणों को सुलझाना भी आसान काम नहीं है। जब परमाणु से अणु बनते हैं तो कई-कई इलेक्ट्रॉन. कई कई परिस्थितियों में, कई-कई नाभिकों के तंत्र के रूप में परस्पर किया करते हैं। ये तंत्र इतने जटिल होते. हैं कि इनकी परस्पर क्रिया की समीकरणों को लिखना व फिर उन्हें हल करना असम्भव-सा ही होता है। लिहाजी आप कई सारी अंतक्रियाओं को अनदेखा कर देते हैं. मान लेते हैं कि वे नगण्य हैं। इस तरह से लगभगीकरण, से ही समझने योग्य मॉडल उभरते हैं। मसलन, दोनों ही सिद्धांतों में बाहयतम कक्षक के इलेक्ट्रॉनों पर ही गौर किया जाता है।
इन दो सिद्धांतों में मुख्य अन्तर क्या है?- संयोजी बंधन सिद्धांत की मूल बात यह है कि इसमें परमाणु के कक्षकों की ही परस्पर क्रिया के आधार पर अणु या बन्धन का निर्माण किया जाता है। हां, यह ज़रूर है कि अन्तक्रिया से पूर्व अलग-अलग परमाणुओं के कक्षकों में परिवर्तन होते हैं। मगर अन्ततः अणु में परमाणुओं के कक्षक मौजूद रहते हैं।
दूसरी ओर आण्विक कक्षक सिद्धांत सहबंध की समस्या पर गौर करते हुए यह मान्यता प्रस्तुत करता है कि परमाणुओं की आपसी क्रिया व अणु बनने के दौरान नए सिरे से कक्षकों का निर्माण होता है जिन्हें आण्विक कक्षक कहते हैं। फिर इलेक्ट्रॉन इन आण्विक कक्षकों में मौजूद रहते हैं।
इस मुख्य अंतर को समझ लेने के बाद, आइए, दोनों सिद्धांतों पर स्वतंत्र रूप से विचार करें।
संयोजी बंधन मॉडल
यह मॉडल मूलतः लुइस के विचारों का ही विस्तार है। लुइस ने यह विचार सामने रखा कि दो परमाणु आपस में एक-एक इलेक्ट्रॉन की साझेदारी करके
तरंग फलन
तरंग फलन (Wave Function) का अर्थ क्या है?
आमतौर पर हम तरंग के आयाम (amplitude) तथा तरंग लंबाई की बात करते हैं। आयाम के आधार पर विचलन का परिमाण पता चलता है। अधिकतम विचलन ही तरंग का आयाम कहलाता है। तरंग लंबाई से पता चलता है कि यह विचलन कितनी आवृति से होता
है। जब हम पदार्थ-तरंगों की बात करते हैं तो उसका तरंग फलन ज्ञात करते हैं। हम यह देखने की कोशिश करते हैं कि तरंग फलन प्रत्येक बिन्दु पर किस तरह परिवर्तित होता है। तरंग फलन एक तरह से आयाम का ही द्योतक है मगर चूंकि यहां पदार्थ-तरंगों की बात हो रही है इसलिए यह थोड़ा अलग भी होता है। ज्यादा महत्वपूर्ण बात यह है कि तरंग फलने के वर्ग से हमें किसी स्थान पर उस पदार्थ (कण ) के पाए जाने की संभाविता का पता चलता है। किसी भी स्थान के तरंग फलन के तीन घटक होते हैं। हमें यह देखना होता है कि x, y और ४ अक्ष पर तरंग फलन किस ढंग से बदलता है। इन तीनों घटकों से मिलकर जो तरंग फलन बनता है उसका वर्ग किसी भी स्थान पर इलेक्ट्रॉन के पाए जाने की संभाविता दर्शाता है।
परस्पर बंधन बनाते हैं। मसलन हाइड्रोजन के एक परमाणु में केन्द्रक के इर्द-गिर्द एक ही इलेक्ट्रॉन होता है। लुइस के मॉडल में इसे निम्नानुसार दर्शाया जाता है :H*। अब हाइड्रोजन के दो परमाणु इस तरह क्रिया करेंगे
H*+ H* → H: H या H - H
किसी वजह से H:H व्यवस्था H* और H* के अलग-अलग रहने की तुलना में ज़्यादा स्थाई है।
आगे चलकर लाइनस पोलिंग, कूल्सन, स्लैटर आदि ने इस मॉडल को और बेहतर बनाया। यदि गणितीय भाग को छोड़ दें तो मूल बात यह है कि इस मॉडल के मुताबिक दो परमाणुओं के कक्षकों (यानी इलेक्ट्रॉन घनत्व) मैं ओवरलैप (अतिव्यापन ) होता है। अर्थात कक्षक एक-दूसरे को कुछ हद तक ढंक लेते हैं और उतने हिस्से में इलेक्ट्रॉन घनत्व बढ़ जाता है। यह बढ़ा हुआ घनत्व दोनों केन्द्रकों के बीच में होता है। दोनों ही केन्द्रक इसे अपनी अपनी ओर खींचते हैं। लिहाजा ये इलेक्ट्रॉन व केन्द्रक आपस में बंध जाते हैं तथा पूरी व्यवस्था की ऊर्जा कम हो जाती है। देखा गया है कि इलेक्ट्रॉन को विवरण के लिए जितनी ज्यादा जगह मिलती है, पूरी व्यवस्था की ऊर्जा उतनी कम होती है। यहां प्रत्येक
हाइड्रोजन की संरचना
यदि हाइड्रोजन अणु बनने की क्रिया को तरंग फलन (Wave Function) के आधार पर देखें तो कुछ ऐसा चित्र उभरता है:
प्रत्येक हाइड्रोजन परमाणु में एक इलेक्ट्रॉन है। इसलिए दो परमाणुओं के दो तरंग फलन लिखे जा सकते हैं। जब ये दो परमाणु पास-पास आते हैं तो इनका एक संयुक्त तरंग फलन लिखा जा सकता है।
परन्त इस तरह से संयुक्त तरंग फलन तैयार कर लेने पर वह हाइड्रोजन अणु की ऊर्जा तथा बन्ध की लम्बाई से मेल नहीं खाता। इस समीकरण में हमने शर्त यह रखी है कि प्रत्येक इलेक्ट्रॉन अपने-अपने केन्द्रक से जुड़ा रहेगा। यदि यह शर्त हटा दी जाए तो तरंग फलन में सुधार होगा। यह सुधार करने पर जो नतीजा प्राप्त होता है वह वास्तविक अवलोकन से ज्यादा मेल खाता है।
अभी भी हमने यह शर्त रखी है कि दोनों इलेक्ट्रॉन अलग-अलग परमाणुओं पर रहेंगे। ऐसा कोई जरूरी नहीं है। हालांकि इलेक्ट्रॉनों के बीच
इलेक्ट्रॉन को उपलब्ध स्थान में वृद्धि हो रही है।
संयोजी बंध सिद्धांत में रासायनिक बंधन के लिए दो इलेक्ट्रॉन की जोड़ी बनती है तथा यह जोड़ी उन दो परमाणुओं के केन्द्रकों के बीच में स्थानबद्ध (Localized) होती है। यानी यह बंध एक स्थानबद्ध बंधन है।
आण्विक कक्षक मॉडल
इस मॉडल की प्रमुख मान्यता यह है कि जब नाभिकों को करीब लाया जाता है और साथ में इलेक्ट्रॉनों को भी जोड़ा जाता है तो ये इलेक्ट्रॉन नए सिरे से आण्विक कक्षकों में वितरित होते हैं। ये आण्विक कक्षक उसी तरह परिभाषित किए आते हैं जिस तरह परमाणु के कक्षकों को किया जाता है। इनकी अपनी क्वांटम संख्याएं होती हैं।
जिस तरह परमाणु कक्षकों को s, p, d, f वगैरह नाम दिए गए हैं उसी तरह आण्विक कक्षकों को सिग्मा (σ), पाइ (π), डेल्टा (δ), फाई (Φ) वगैरह नाम से पुकारा जाता।
विकर्षण के चलते वे दूर-दूर रहेंगे मगर कभी कभार जरूर दोनों एक ही परमाणु पर पहुंच जाएंगे। तो हमें निम्नानुसार रचनाएं मिलेंगी:
H-H ↔ H+H- ↔ H-H+
पहली रचना यानी हाइड्रोजन के दो परमाणुओं से बने एक अणु में दोनों इलेक्ट्रॉन बीच में स्थित हैं। दूसरी रचना में दोनों इलेक्ट्रॉन दूसरे परमाणु पर हैं। और आखिरी रचना में दोनों इलेक्ट्रॉन पहले परमाणु पर हैं।
इस तरह से विभिन्न शर्तों पर विचार करते हुए तरंग फलन का समीकरण लिखा जाता है और देखा जाता है कि कौन-सा तरंग फलन अणु के वास्तविक अवलोकनों के ज्यादा करीब है। इन शर्ते से उस अणु की परिकल्पना उभरती है।
हाइड्रोजन अणु के लिए जो तरंग फलन है उसमें सबंध व आयनिक बंध दोनों का योगदान है। हाइड्रोजन की लुइस रचनाएं H-H ↔ H+H- ↔ H-H+हाइड्रोजन अणु की रचना में योगदान देती हैं। कई बार भ्रम हो जाता है कि हाइड्रोजन अणु इन तीन रचनाओं के बीच डोलता रहता है, यानी कभी यहां तो कभी वहां। यह सही नहीं है। हाइड्रोजन की संरचना तो एक ही है। लेकिन वह हमें पता नहीं है - परन्तु इन तीन रचनाओं के बीच की है, यह हम ज़रूर कह सकते हैं।
परमाणु कक्षकों की परस्पर अंतक्रिया से आण्विक कक्षकों की गणना करने के कई तरीके हो सकते हैं। दरअसल सारे तरीके कुछ मान्यताओं यानी लगभगीकरण पर टिके हैं।
इनमें से एक तरीका है परमाणु कक्षकों का रेखीय सम्मिश्रण (Linear Combination Of Atomic Orbitals) यह तरीका लगभग वैसा ही है जैसे हमने संकरण की क्रिया में एक ही परमाणु के कक्षकों के सम्मिश्रण में देखा था। अंतर सिर्फ यह है कि यहां एकाधिक परमाणुओं की बात हो रही है। सम्मिश्रित ( आण्विक ) कक्षक पूरे अणु के अंग होते हैं।
कुल मिलाकर प्रक्रिया यह है कि समस्त परमाणु कक्षकों के मेल से आण्विक कक्षक बना लिए जाएं। इसमें सुविधा के लिए सिर्फ बाह्यतम कक्षकों को ही लिया जाता है। जो आण्विक कक्षक बनते हैं उन्हें उनकी तुलनात्मक ऊर्जा के क्रम में जमा लिया जाता है और फिर इन्हें उपलब्ध इलेक्ट्रॉनों से भरा जाता है। जब सारे इलेक्ट्रॉन भर जाते हैं तो फिर गौर किया जाता है। कि इसमें ऊर्जा की क्या स्थिति है। पूरी व्यवस्था की ऊर्जा परमाणुओं से कम हो तभी यह ज्यादा स्थाई व्यवस्था होगी। ।
यहां कुछ सरल उदाहरणों से बात को समझने की कोशिश करते हैं।
कक्षकों का संकरण(Hybridisation)
संयोजी बंधन सिद्धांत में मूलतः यह माना जाता है कि परमाणुओं के कक्षकों की परस्पर क्रिया ( ओवरलैपिंग ) के जरिए पूरी व्यवस्था की ऊर्जा कम होने की स्थिति आती है। मगर इस अन्तक्रिया से पूर्व प्रायः परमाणुओं के कक्षकों में फेरबदल होते हैं। इस फेरबदल का परिणाम यह होता है कि कक्षकों के एक दूसरे को ढंकने का परिमाण बढ़ जाता है। इस तरह का एक फेरबदल कक्षकों का संकरण है।
उदाहरण के तौर पर कार्बन को लें - इसकी परमाणु संरचना निम्नानुसार हैः
C = 1s2 2s2 2px1 2py1
इस स्थिति में कार्बन परमाणु में px व py कक्षकों में एक-एक गैर युग्मित इलेक्ट्रॉन है। यानी कार्बन द्विसंयोजी होगा। परन्तु कार्बन के स्थाई यौगिकों में कार्बन अतुसंयोजी होता है। संयोजी बंधन सिद्धांत में माना जाता है कि कार्बन के 2s कक्ष के एक इलेक्ट्रॉन को आगे बढ़ा दिया जाता है और वह pz झक में पहुंच जाता है। इस उत्तेजित अवस्था की इलेक्ट्रॉनिक संरचना निम्नानुसार होती हैः
मसलन H2 H2+ तथा He2 के बनने के उदाहरण लें।
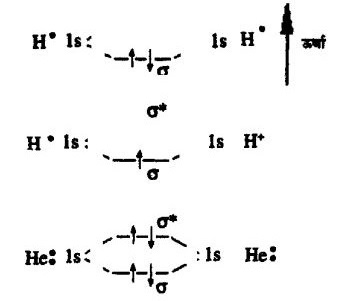 उपरोक्त चित्र से स्पष्ट है कि H2 व H2+ बनना तो संभव है मगर He2 नहीं बन सकता ।
उपरोक्त चित्र से स्पष्ट है कि H2 व H2+ बनना तो संभव है मगर He2 नहीं बन सकता ।
तो संक्षेप में हमने संयोजी बंधन सिद्धांत और आण्विक कक्षक सिद्धांत की चर्चा की। अभी भी कई पक्ष छूट गए हैं। इन दोनों मॉडलों की अपनी अपनी खूबियां व कमियां हैं। उनकी गहराई में अभी हम नहीं जा रहे हैं। यह भी संभव है कि सारी बातें अस्पष्ट रही होंगी। इनकी स्पष्टता के लिए जरूरी होगा कि आप अपने मत विचार लिख भेजें।
आण्विक कक्षक मॉडल में दो 1s कक्षकों की अन्तक्रिया से दो नए आण्विक कक्षक σ और σ* बनते हैं। जाहिर है कि σ कि ऊर्जा σ* से कम होगी। पहले चित्र में H2 में दोनों इलेक्ट्रॉन कम ऊर्जा वाले कक्षक में है। दूसरे चित्र में H+ में केवल एक इलेक्ट्रॉन है, वह भी कम ऊर्जा वाले कक्षक में स्थित है।परन्तु आखिरी चित्र में He2 बनाने के लिए उपलब्ध चार इलेक्ट्रॉन में से दो σ में रहेंगे और अन्य दो σ* में। क्योंकि σ* ज्यादा ऊर्जा वाला कक्षक है। इसलिए He2 नहीं पाया जाता।
C* = 1s2 2s1 2px1 2py1 2pz1
एक इलेक्ट्रॉन की इस उन्नति में 406 किलो जूल प्रति मोल ऊर्जा खर्च होती है। 2s व 2p कक्षकों के इलेक्ट्रॉन का परस्पर सम्मिश्रण (या रेखीय सम्मिश्रण ) होता है तथा इन अलग-अलग कक्षकों में से चार परस्पर तुल्य कक्षकों का निर्माण होता है। चूंकि इन नए कक्षकों के निर्माण में 1s तथा 3p कक्षकों का मिश्रण होता है इसलिए इन्हें sp3 संकरित कक्षक करते हैं। इस तरह के कई संकरण सम्भव हैं - sp, sp2, sp3, dsp2 d2sp3 वगैरह।
इलेक्ट्रॉन को आगे बढ़ाने तथा संकरण में ऊर्जा खर्च होती है यानी परमाणु की ऊर्जा में बढ़ोतरी होती है। मगर इसकी बदौलत जो अतिरिक्त बंधन बनते हैं उनकी वजह से ऊर्जा कम होकर व्यवस्था में स्थायित्व आता है। परन्तु संकरण की प्रेरक शक्ति क्या है, इसे लेकर ज्यादा कुछ नहीं कहा जा सकता।
सुशील जोशी - पर्यावरण एवं विज्ञान लेखन में सक्रिय। होशंगाबाद विज्ञान शिक्षण कार्यक्रम से

