सुशील जोशी
क्यों और कैसे जुड़ते हैं एक ही तत्व के परमाणु, आपस में।
गैसों के साथ गैलूसैक द्वारा किए गए प्रयोग और डाल्टन के परमाणु सिद्धांत के बीच अंतद्र्वन्द्व उत्पन्न हो गया था। गैलूसैक के प्रयोगों के निष्कर्ष कुछ ऐसे निकलते थे कि परमाणु को विभाज्य मानना पड़ता था। डाल्टन के परमाणु सिद्धांत के मुताबिक तो परमाणु समाधान एवोगेड्रो ने किया - अणु की अवधारणा के ज़रिए। एवोगेड्रो ने कहा कि गैंसे एकाधिक परमाणुओं से मिलकर बने अणुओं के रूप में रहती हैं। उन्होंने यह भी बताया कि समान ताप व दाब पर गैसों के बराबर आयतन में अणुओं की संख्या बराबर होती है।
तो एवोगेड्रो के मुताबिक हाइड्रोजन, H के रूप में नहीं H2 के रूप में पाई जाती है। इसी प्रकार से ऑक्सीजन O2 , नाइट्रोजन N2, क्लोरीन आदि रूप में पाई जाती हैं। तब इस बात पर शंका व्यक्त की गई कि एक ही तत्व के दो परमाणु आपस में कैसे जुड़ सकते हैं।
इस शंका के मूल में उस समय रासायनिक बन्धन के संबंध में प्रचलित धारणा थी। यहां हम उन्हीं में से एक धारणा पर विचार करेंगे।
दरअसल उस समय यह तो भलीभांति पता था कि प्रकृति में कई पदार्थ (अधिकतर पदार्थ) तात्विक रूप में नहीं बल्कि यौगिक रूप में पाए जाते हैं। लिहाज़ा यह समझने की लालसा स्वाभाविक थी कि इन तत्वों को आपस में जोड़ने वाली शक्ति कौन-सी है।
सबसे पहले तो यह देखा जाए कि तत्वों को जोड़ने वाली शक्ति को लेकर कोई भी निष्कर्ष निकालने के लिए उस समय (19वीं सदी के मध्य व उत्तरार्ध) रसायनज्ञों के पास क्या-क्या जानकारी उपलब्ध थी:
- दो किस्म के तत्व पता थे - धातु व अधातु।
- आकर्षण का प्रमुख बल ऋण व धन आवेशों के बीच लगने वाला बल था। गुरुत्व बल कमजोर था और विशिष्ट नहीं था। चुम्बकीय बल के बारे में पता था। कि उसके ध्रुवों को अलग-अलग नहीं किया जा सकता।
- धातुएं सिर्फ अधातुओं के साथ क्रिया करती हैं।
- अधातुए धातुओं के साथ क्रिया करने के अलावा आपस में भी क्रिया करती हैं।
- किसी भी यौगिक में तत्वों के परमाणुओं का अनुपात छोटी पूर्णांक संख्या में होता है।
- तत्वों के कुछ समूह रासायनिक क्रियाओं के दौरान अपरिवर्तित रहते हैं जैसे SO2, OH वगैरह।
- कई धातुएं दो तरह से क्रिया करती हैं। यानी उनमें एक ही पदार्थ से क्रिया होने पर दो तरह के पदार्थ बनने की संभावना रहती है।
- कई अलग-अलग यौगिकों के अणु सूत्र समान होते हैं जैसे इथाइल अल्कोहल और डाई मिथाइल ईथर।
उपरोक्त तथ्यों के आधार पर ही ऐसी परिकल्पनाएं की जाना थीं जो इन सारे तथ्यों की व्याख्या भी कर सकें। ये सारी परिकल्पनाएं करीब 1850 - 1870 में सामने आई।
इस मामले में सबसे पहला सिद्धांत विद्युतीय आकर्षण का उभरा। वैसे यह स्वाभाविक भी था। विद्युत अपघटन यानी इलेक्ट्रोलिसिस का काफी अध्ययन हो चुका था - वोल्टा की सेल, डेवी के प्रयोग, फैरेडै द्वारा विद्युत अपघटन संबंधी मात्रात्मक प्रयोगों आदि से यह बात स्पष्ट हो चुकी थी कि कई यौगिकों का विद्युत अपघटन होने पर एक भाग (धातु) ऋण इलेक्ट्रोड की ओर जाता है इसके आधार पर यह प्रस्ताव रखा गया कि धातुएं धनात्मक व अधातुएं ऋणात्मक होती हैं तथा इनमें परस्पर आकर्षण होता है। आगे चलकर इसे विद्युत संयोजकता या आयनिक बंधन कहा गया। यह आसानी से स्वीकार भी हो गया क्योंकि ज्ञात तथ्य इसकी पुष्टि करते थे।
क्या है आयनिक बंधन
यहां हम इसी आयनिक बंध की बात करेंगे। हमें यह बात करने के लिए मानकर चलना होगा कि परमाणु की संरचना के दो मूल घटक यानी इलेक्ट्रॉन व केन्द्रक के बारे में जानकारी मौजूद है। इलेक्ट्रॉन ऋणावेशित होता है तथा केन्द्रक धनावेशित होता है। मगर इस सबकी बात करते हुए या उनके बारे में पढ़ते हुए आमतौर पर कुछ सतर्कताएं बरतना ज़रूरी है।
पहली सतर्कता तो यह रखना पड़ती है कि अक्सर इलेक्ट्रॉन को बिन्दु, X , गोले तिकोने आदि चिन्हों से दर्शाया जाता है। इन चिन्हों का इलेक्ट्रॉन के आकार, आकृति आदि से कोई संबंध नहीं है।
दूसरी सतर्कता कि कई बार अलग-अलग तत्वों के इलेक्ट्रॉन को अलग-अलग चिन्हों से भी दर्शाया जाता है। इसका अर्थ यह नहीं है कि इन इलेक्ट्रॉनों के बीच किसी भी तरह का कोई अन्तर है।
तीसरी सतर्कता यह कि यहां जिस आयनिक बंधन की चर्चा कर रहे हैं वह कदाचित आदर्श स्थिति है। वास्वत में जो बंधन बनते हैं वे शुद्ध आयनिक बंधन न होकर कई तरह ही बंधन शक्तियों के मिले जुले रूप होते हैं।
आयनिक बंधक का अर्थ यह होता है कि दो अलग-अलग तत्वों के परमाणु आयनों का रूप ले लें और ये आयन परस्पर आकर्षक की वजह से साथ-साथ टिके रहें। ज़ाहिर है कि उन्हीं आयनों के बीच परस्पर आकर्षक होगा जिन पर परस्पर विपरीत आवेश हो। इसका अर्थ यह है कि आयनिक बंधन बनने का पहला कदम आयनों का बनना होगा। तो आयन कैसे बनते हैं?
इलेक्ट्रॉन का खेल आयन बनने की क्रिया को समझने के लिए कि भी परमाणु की कल्पना कीजिए। परमाणु के बीचों-बीच धनावेशित केन्द्रक है और केन्द्रक के इर्दगिर्द ऋणावेशित इलेक्ट्रॉन ‘चक्कर’ काट रहे हैं। केन्द्रक पर कुल धनावेश और सारे इलेक्ट्रॉनों का कुल ऋणावेश आपस में संतुलित है तथा परमाणु उदासीन है।
आयन बनने की क्रिया को समझने के लिए कि भी परमाणु की कल्पना कीजिए। परमाणु के बीचों-बीच धनावेशित केन्द्रक है और केन्द्रक के इर्दगिर्द ऋणावेशित इलेक्ट्रॉन ‘चक्कर’ काट रहे हैं। केन्द्रक पर कुल धनावेश और सारे इलेक्ट्रॉनों का कुल ऋणावेश आपस में संतुलित है तथा परमाणु उदासीन है।
अब यदि धनायन बनाना है, तो इलेक्ट्रॉनों की संख्या में कमी करना होगी। यानी जो इलेक्ट्रॉन आवेशों के परस्पर आकर्षण की वजह से केन्द्रक के इर्द-गिर्द ‘चक्कर’ काट रहा है उसे वहां से दूर हटाना होगा कि वह ‘मुक्त’ हो जाए। ज़ाहिर है कि इस काम में ऊर्जा लगेगी। ऊर्जा की मात्रा इस बात पर निर्भर होगी कि केन्द्रक में कितना धनावेश है तथा वह इलेट्रॉन केन्द्रक से कितना दूर है। इसीलिए यदि इलेक्ट्रॉन केन्द्रक के ईद-गिर्द विभिन्न दूरियों पर हों, तो सबसे बाहर वाले इलेक्ट्रॉन को ‘मुक्त’ करना सबसे आसान होता है (देखिए तालिका)। इस तरह इलेक्ट्रॉन मुक्त कराकर आयन बनाने में लगी ऊर्जा को ‘आयनीकरण ऊर्जा’ कहते है।
दूरी ओर किस तत्व के परमाणु को ऋणायन में तब्दील करने के लिए ज़रूरी होता है कि उसमें इलेक्ट्रॉनों की संख्या बढ़ाई जाए। आवेशों की दृष्टि से संतुलित परमाणु में एक और इलेक्ट्रॉन घुसाने में भी ऊर्जा परिवर्तन होते हैं। कुछ तत्व ऐसे हैं जिनमें इलेक्ट्रॉन प्रविष्ट कराने पर ऊर्जा निकलती हैं जबकि अन्य तत्वों में इस क्रिया में भी ऊर्जा खर्च होती है। जब ऊर्जा निकलती है तो उसे ऋण चिन्ह दिया जाता है तथा जब ऊर्जा सोखी जाती है तो धन चिन्ह दिया जाता है। इस ऊर्जा को ‘इलेक्ट्रॉन लगाव ऊर्जा’ का नाम दिया गया है।

धनायन कैसे बनेगा:किसी संतुलित परमाणु को धनायन बनाने के लिए उसमें से इलेक्ट्रॉन मुक्त कराने की ज़रूरत होती है।
इसके लिए बाहर से अतिरिक्त ऊर्जा दी जाती है। इस आवश्यक ऊर्जा को आयनीकरण ऊर्जा कहते हैं। ऊर्जा की यह मात्रा इस बात पर निर्भर करती है कि इलेक्ट्रॉन केंद्रक से कितना दूर है। केंद्रक से सबसे दूर के इलेक्ट्रॉन केंद्रक से कितना दूर है। केंद्रक से सबसे दूर के इलेक्ट्रॉन को मुक्त कराना सबसे आसान होता है।
तालिका और ग्राफ के लिए यह ऊर्जा किलो/मोल में दिखाई गई है। इस ग्राफ या तालिका को देखकर पता चलता है कि एक इलेक्ट्रॉन को निकालने के लिए जितनी ऊर्जा लगेगी दूसरे इलेक्ट्रॉन को निकालने के लिए उससे कहीं ज़्यादा ऊर्जा की ज़रूरत होती है। लेकिन अगर तत्व ने एक बार अष्टक संरचना (उसकी बाहरी कक्षा में आठ इलेक्ट्रॉन हो गए हैं) प्राप्त कर ली है तो अब उसमें से इलेक्ट्रॉन निकालना आसान नहीं होता। इसके लिए अत्यधिक ऊर्जा की ज़रूरत होती है। तालिका में यह स्थिति गई है। घेरे में जो ऊर्जा की मात्रा है वह अष्टक से एक इलेक्ट्रॉन निकालने के लिए लगने वाली मात्रा है।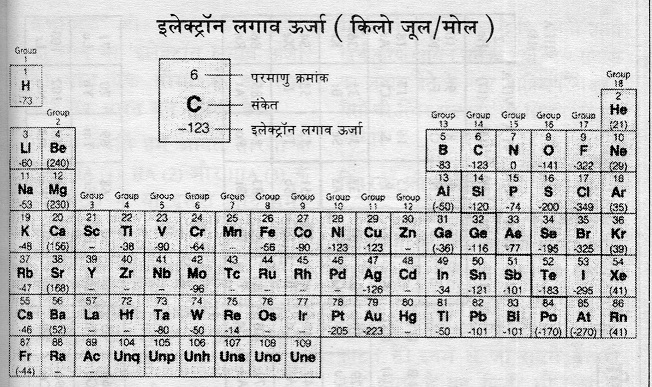 ऋणायन बनाने के लिए: किसी भी परमाणु को ऋणायन में तब्दील करने के लिए ज़रूरी है कि उसमें इलेक्ट्रॉन को प्रवेश कराया जाए। इस रासायनिक क्रिया में भी ऊर्जा परिवर्तन होते हैं। कुछ में ऊर्जा निकलती है तो कुछ में बाहर से ऊर्जा दी जाती है। इस ऊर्जा को इलेक्ट्रॉन लगाव ऊर्जा कहते हैं।
ऋणायन बनाने के लिए: किसी भी परमाणु को ऋणायन में तब्दील करने के लिए ज़रूरी है कि उसमें इलेक्ट्रॉन को प्रवेश कराया जाए। इस रासायनिक क्रिया में भी ऊर्जा परिवर्तन होते हैं। कुछ में ऊर्जा निकलती है तो कुछ में बाहर से ऊर्जा दी जाती है। इस ऊर्जा को इलेक्ट्रॉन लगाव ऊर्जा कहते हैं।
इस तालिका में हर तत्व के नीचे दी गई ऊर्जा उसकी इलेक्ट्रॉन लगाव ऊर्जा है।
यहां हम रासायनिक क्रियाओं के महत्वपूर्ण पक्ष पर आ जाते हैं। किसी भी रासायनिक क्रिया का अध्ययन करते वक्त उसमें होने वाले ऊर्जा परिवर्तन का भी ध्यान रखना ज़रूरी होता है। यदि किसी क्रिया के दौरान क्रिया करने वाले पदार्थ खूब सारी ऊर्जा सोखकर पदार्थ बनाते हैं, तो उस नए पदार्थ में ज़्यादा आंतरिक ऊर्जा संचित होगी यह पदार्थ क्रिया करने वाले पदार्थों की तुलना में अस्थिर होगा।
मतलब यदि ऊर्जा की दृष्टि से देखें तो आयनिक बंधन उन्हीं तत्वों की बीच संभव है जिनकी आयनीकरण की ऊर्जा तथा इलेक्ट्रॉन लगाव की ऊर्जा अनुकूल हो। यानी कि ‘आयनीकरण ऊर्जा’ कम हो और ‘इलेक्ट्रॉन लगाव ऊर्जा’ भी कम हो। यहां पर शायद एक बार फिर से दोहरा लेना चाहिए कि आयनीकरण ऊर्जा सदैव धनात्मक होती हैं। जबकि ‘इलेक्ट्रॉन लगाव ऊर्जा’ धनात्मक भी हो सकती है और ऋणात्मक। भी। ‘आयनीकरण ऊर्जा’ का मान या ‘इलेक्ट्रॉन लगाव की ऊर्जा’ का मान एक सीमा में हो तभी आयनिक बंधन बन सकता है।
यह स्थिति हमें आवर्त सारणी के समूह IA (1) IIA(2) और IIIA(3) के कुछ तत्वों में या दूसरी ओर समूह VIIA(17), VIA (16) के तत्वों और नाइट्रोजन में ही प्राप्त होती है। आयनिक बंधन मूलत: इन्हीं के बीच बनते हैं। सिर्फ हैलोजन (क्लोरीन, ब्रोमीन, आयोडीन, फ्लोरीन) ही वह समूह है जिसमें ‘इलेक्ट्रॉन लगाव ऊर्जा’ काफी ऋणात्मक होती है।
परन्तु अभी भी एक प्रमुख सवाल रह जाता है। आयनिक बंधन बनने की प्रक्रिया का पहला कदम है आयनों का बनना। हमने देखा कि तत्व के परमाणु से आयन बनने में ऊर्जा परिवर्तन होता है। आयन बनने की प्रक्रिया के दौरान आमतौर पर आयनों की कुल ऊर्जा, शरुआती तत्वों से थोड़ी ज़्यादा ही होती हे; जैसा कि आगे दिए गए सोडियम क्लोराइड के उदाहरण में स्पष्ट होता है।
ऊपर ज़िक्र किए गए कुछ तत्वों में चाहे स्थिति बहुत प्रतिकूल नहीं है मगर फिर भी सवाल है कि इतनी ऊर्जा खर्च करके आयन बनें ही क्यों? इस सवाल का जवाब देने के लिए ‘अक्रिय (नोबल) गैसों की स्थिर संरचना’ का सिद्धांत सामने आया।
स्थिरता की कोशिश में
यदि हम केन्द्रक के इर्द-गिर्द इलेक्ट्रॉनों के वितरण को थोड़ा और बारीकी से देखें तो पाते हैं कि ये इलेक्ट्रॉन अलग-अलग स्तरों पर, केन्द्रक से अलग-अलग दूरी पर चक्कर काटते हैं। इनमें से जो सबसे बाहरी स्तर होता है वह किसी भी तत्व के रासायनिक गुणों की दृष्टि से अत्यंत महत्वपूर्ण है। नोबल गैसों (यानी हीलियम, नियॉन आर्गन, क्रिप्टॉन, ज़ेनॉन, रेडॉन) में हीलियम को छोड़कर बाकी सभी गैसों के बाहुयतम स्तर पर पाठ इलेक्ट्रॉन होते हैं। लुईस ने सिद्धांत दिया कि इन गैसों की तुलनात्मक अक्रियता का राज़ इसी अष्टक में है। उन्होंने यह भी स्पष्ट किया कि शेष तत्व भी आपस में बन्धन बनाकर यही ‘अक्रिय’ संरचना प्राप्त कर लेते हैं। यह ‘अष्टक’ अत्यंत स्थिर संरचना है।
तो इस सिद्धांत को लागू करके यह देखा जा सकता है कि समूह क्ष्ॠ की धातुएं जब एक इलेक्ट्रॉन छोड़ती हैं तो उनकी शेष बची संरचना ‘अक्रिय अष्टक’ नुमा हो जाती है। समूह क्ष्क्ष्ॠ व क्ष्क्ष्क्ष्ॠ की धातुओं को यही स्थिति प्राप्त करने के लिए क्रमश: दो व तीन इलेक्ट्रॉन से निजात पानी होगी।
*किसी क्रिया के दौरान पदार्थ का ऊर्जा का परिणाम ऋणात्मक है तो उस क्रिया के दौरान पदार्थ ने ऊर्जा छोड़ी है, अर्थात क्रिया के बाद उस ऊर्जा कम हुई है। इसी तरह धनात्मक ऊर्जा का अर्थ है कि पदार्थ ने ऊर्जा अवशेषित की है यानी कि क्रिया के पूर्ण होने पर पदार्थ की कुल ऊर्जा में वृद्धि हुई है।
इसी प्रकार समूह ज्क्ष्ॠ व ज्क्ष्क्ष्ॠ की धातुएं क्रमश: दो व तीन इलेक्ट्रॉन हासिल करें तो वे अष्टक अवस्था प्राप्त कर लेती हैं। यह उन्हें एक स्थिरता प्रदान करता है।
संरचना और ऊर्जा
परन्तु यहां भी एक दिक्कत है। यह तो सही है कि अष्टक की स्थिरता की वजह से हैलोजन तत्वों के आयन उनके परमाणुओं की तुलना में ज़्यादा स्थिर होते हैं। उनके आयनों की आन्तरिक ऊर्जा परमाणुओं से करीब 300 किलो जूल। प्रति मोल कम है। मगर ऑक्सीजन आयन (O 2 -), सल्फर (S 2 -), नाइट्रोजन (N 3 -), सोडियम (Na +), मैग्नीशियम (Mg 2 +), तथा कैल्शियम (Ca 2 +) आयन अपने तत्व के परमाणुओं के मुकाबले 250 से 2200 किलो जूल प्रति मोल ज़्यादा ऊर्जा रखते हैं। इनमें भी नोबल गैस संरचना तो मौजूद है मगर ये स्वतंत्र परमाणुओं की तुलना में ज़्यादा ऊर्जा रखे हुए हैं।
मसलन यदि सोडियम व क्लोरीन से सोडियम क्लोराइड बनने का उदाहरण लें तो स्थिति कुछ इस तरह दर्शाई जा सकती है:

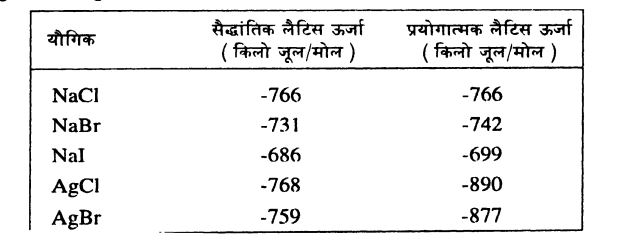
*जूल - जेम्स प्रेसकॉट जूल के नाम पर रखी गई ऊर्जा की इकाई। किलोजूल अर्थात 1000 जूल। उपरोक्त चित्र से स्पष्ट है कि आयन बनने तक तो Na+(g) ´É CI - (g), ठोस सोडियम व गैसीय क्लोरीन के मुकाबले ज़्यादा अस्थिर हैं। यहां आकर वह क्रिया होती है जिसके ज़रिए Na+ व CI - आकर्षित होकर पास-पास आते हैं तथा ठोस रूप ले लेते हैं। ठोस रूप में ये आयन मिलकर एक जाल (लैटिस) का रूप ले लेते हैं। लैटिस रचना की इस क्रिया में काफी सारी ऊर्जा निकलती है और सोडियम क्लोराइड की आंतरिक ऊर्जा इतनी कम हो जाती है कि वह स्थिरता प्राप्त कर लेता है। मसलन Na+ ´É CI - से NaCI (ठोस) बनने की लैटिस ऊर्जा (-) 766 किलो जूल है। दरअसल आयनिक बंधनों से बने पदार्थो के गुण काफी कुछ इस लैटिस ऊर्जा पर निर्भर होते हैं।
उपरोक्त चित्र से स्पष्ट है कि आयन बनने तक तो Na+(g) ´É CI - (g), ठोस सोडियम व गैसीय क्लोरीन के मुकाबले ज़्यादा अस्थिर हैं। यहां आकर वह क्रिया होती है जिसके ज़रिए Na+ व CI - आकर्षित होकर पास-पास आते हैं तथा ठोस रूप ले लेते हैं। ठोस रूप में ये आयन मिलकर एक जाल (लैटिस) का रूप ले लेते हैं। लैटिस रचना की इस क्रिया में काफी सारी ऊर्जा निकलती है और सोडियम क्लोराइड की आंतरिक ऊर्जा इतनी कम हो जाती है कि वह स्थिरता प्राप्त कर लेता है। मसलन Na+ ´É CI - से NaCI (ठोस) बनने की लैटिस ऊर्जा (-) 766 किलो जूल है। दरअसल आयनिक बंधनों से बने पदार्थो के गुण काफी कुछ इस लैटिस ऊर्जा पर निर्भर होते हैं।
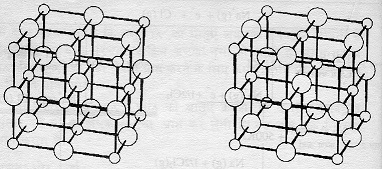
उदाहरण के लिए आमतौर पर ठोस आयनिक पदार्थो का गलनांक व क्वथनांक बहुत ज़्यादा होता है। कारण यह है कि इनकी लैटिसनुमा संरचना तो तोड़ने में बहुत ऊर्जा (उष्मा) लगानी पड़ती है। आयनों के बीच ठोस अवस्था में जो परस्पर आकर्षण होता है वह काफी शक्तिशाली होता है। इसी आकर्षण के कारण ये पदार्थ काफी कठोर भी होते हैं, मगर लैटिस की संरचना के कारण ये पदार्थ भंगुर भी होते हैं। इनके क्रिस्टल पर किसी खास तल पर हल्का-सा दबाव डालने से ही ये टूट जाएंगे। इसके मूल में भी एक व्यवस्थित लैटिस संरचना ही है। उदाहरण लैटिस के लिए सोडियम क्लोराइड (ठोस अवस्था) की लैटिस संरचना चित्र में दिखाई गई हैं।
आयनिक पदार्थ ठोस अवस्था में विद्युत के कुचालक हैं जबकि तरल (पिघली हुई) अवस्था में सुचालक होते हैं। कारण यही है कि ठोस अवस्था में आयन विद्युत का संवहन करने को मुक्त नहीं होते, लैटिस में जकड़े रहते हैं। जबकि तरल अथवा घुलित अवस्था में ये आयन एक-दूसरे से स्वतंत्र होते हैं।
एक बार जब आयनिक पदार्थो में बंधन के गुणधर्म को समझ लें, तो कई सारी बातें एक पैटर्न में फिट होने लगती हैं। जैसे सोडियम से आयन ही क्यों बनता है, क्यों नहीं? दूसरी ओर कैल्श्यिम हर बार आयन ही क्यों बनाता है? या आयन बन सकता है क्या?
इनमें से कुछ सवालों पर हम आगे गौर करेंगे। और आयनिक बंधन के अलावा और भी कई तरीके हैं तत्वों के मेल मिलाप के, जैसे सहबंध। फिलहाल उसे मुत्तवी रखते हैं।
सुशील जोशी - पर्यावरण एवं विज्ञान लेखन में सक्रिय होशंगाबाद विज्ञान शिक्षण कार्यक्रम से संबद्ध।