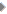अभय कर्नाटकी, अरुण बनपूरकर, प्रियदर्शनी कर्वे किसी हरे-भरे प्रदेश में हिरणों का एक झुण्ड रहता था और सिंहों का एक झुण्ड भी। हिरण हरी भरी नरम घास खाकर अपना गुज़ारा करते थे, जबकि सिंह हिरणों को अपना भोजन बनाते थे। जब कभी हिरणों की संख्या बढ़ जाती थी तब निरंतर चराई से घास नष्ट होने लगती, घास की वृद्धि रुक जाती थी। ऐसे समय में सिंहों के लिए मैदान साफ हो जाता था। हिरणों का शिकार आसान हो जाता था, परिणामस्वरूप हिरणों की संख्या कम होने लगती और सिंहों की संख्या बढ़ने लगती थी। हिरणों की संख्या घटने पर घास में तेज़ी से वृद्धि होने लगती, सिंहों को शिकार पकड़ने में दिक्कत होने लगती और भोजन की कमी से उनकी संख्या घटनी शुरू हो जाती। इस प्रकार घास के बढ़ने की दर और हिरणों द्वारा घास के भक्षण की दर में बारी-बारी से होने वाली घट-बढ़ के साथ ही, हिरण और सिंहों की संख्या में भी घट-बढ़ होती रहती थी। बाहर से कोई हस्तक्षेप न होने की स्थिति में घट-बढ़ का यह दोलन लगातार जारी रहता था।
किसी हरे-भरे प्रदेश में हिरणों का एक झुण्ड रहता था और सिंहों का एक झुण्ड भी। हिरण हरी भरी नरम घास खाकर अपना गुज़ारा करते थे, जबकि सिंह हिरणों को अपना भोजन बनाते थे। जब कभी हिरणों की संख्या बढ़ जाती थी तब निरंतर चराई से घास नष्ट होने लगती, घास की वृद्धि रुक जाती थी। ऐसे समय में सिंहों के लिए मैदान साफ हो जाता था। हिरणों का शिकार आसान हो जाता था, परिणामस्वरूप हिरणों की संख्या कम होने लगती और सिंहों की संख्या बढ़ने लगती थी। हिरणों की संख्या घटने पर घास में तेज़ी से वृद्धि होने लगती, सिंहों को शिकार पकड़ने में दिक्कत होने लगती और भोजन की कमी से उनकी संख्या घटनी शुरू हो जाती। इस प्रकार घास के बढ़ने की दर और हिरणों द्वारा घास के भक्षण की दर में बारी-बारी से होने वाली घट-बढ़ के साथ ही, हिरण और सिंहों की संख्या में भी घट-बढ़ होती रहती थी। बाहर से कोई हस्तक्षेप न होने की स्थिति में घट-बढ़ का यह दोलन लगातार जारी रहता था।
जैविक प्रणालियों में इस प्रकार के दोलनों के कई उदाहरण देखने को मिलते हैं। जैविक प्रणालियां अपने आसपास के परिवेश के साथ ऊर्जा का आदान-प्रदान करती रहती हैं। उपरोक्त उदाहरण में बाहर से सूर्य-प्रकाश, पानी व अन्य पोषक तत्व उपलब्ध होने से घास की वृद्धि होती रहती है। इसी वजह से इस प्रणाली में प्राणियों की संख्या में घट-बढ़ के दोलन की संभावना बनी रहती है। मान लीजिए एक पिंजरे में हम घास की सीमित मात्रा रख देते हैं और पिंजरे में कुछ हिरण और सिंहों को बंद कर देते हैं। इस परिस्थिति में आपको हिरण व सिंहों की संख्या में घट-बढ़ यानी दोलन नहीं दिखेंगे क्योंकि हिरण चारा खा लेंगे, सिंह हिरणों का सफाया कर देंगे और अंततः भोजन के अभाव में वे भी मर जाएंगे। तात्पर्य यह है कि दोलन केवल खुली प्रणाली (Open System) में ही संभव होते हैं। बंद प्रणाली (Close System) में जहां आसपास के परिवेश के साथ किसी भी प्रकार का आदान-प्रदान संभव नहीं हो, कोई भी प्रक्रिया प्रारंभ होने पर केवल एक ही दिशा में आगे बढ़ती जाती है, प्रक्रिया की वापसी की कोई गुंजाइश नहीं होती है। यह कुदरत का कायदा है। यही कारण है कि पानी से भरे गिलास में स्याही की बूंद टपकाने पर धीरे-धीरे स्याही पूरे पानी में फैल जाती हैं। इस सच्चाई पर सभी विश्वास कर लेते हैं, वे भी जिन्होंने प्रत्यक्ष रूप से इस प्रयोग को करके नहीं देखा है। ऐसे में यदि कोई कहे कि कुछ समय पश्चात स्याही के कण पुनः एक बूंद के रूप में एकत्रित हो गए तो एकाएक इस बात पर कोई विश्वास नहीं करेगा। इस प्रयोग को करके देखने का ख्याल भी दिल में नहीं आएगा। यही नहीं, इस घटना को घटते हुए देखने पर भी लोग यहीं सोचेंगे कि ज़रूर इसमें कोई हाथ की सफाई है।
बेलुसोव के अवलोकन
ऐसे ही कुछ अनुभवों से सन् 1951 में रूसी वैज्ञानिक बोरिस बेलुसोव को रु-ब-रु होना पड़ा। उस समय वो एक सैनिक प्रयोगशाला में रिसर्च करने वाला रसायनविद था। वो वहां ग्लाइकोलिसिस नामक जैव-रासायनिक प्रक्रिया का अध्ययन कर रहा था। जीवित कोशिकाओं में ग्लूकोज़ के अणु विघटित होकर ऊर्जा मुक्त करते हैं, इस प्रक्रिया को ग्लाइकोलिसिस कहते हैं। बेलुसोव इस प्रक्रिया के एक छोटे हिस्से को प्रयोगशाला में सम्पन्न कराने का प्रयास कर रहा था। उसने जो देखा वह अचंभित करने वाली घटना थी। रासायनिक प्रक्रिया पूर्णता की ओर अग्रसर नहीं हो रही थी, बल्कि आगे और पीछे की दिशा में दोलन करती हुई प्रतीत हो रही थी। मूलतः जो मिश्रण रंगहीन था वह कुछ समय पश्चात पीला रंग ग्रहण कर लेता था, और निश्चित अंतराल के बाद रंगहीन हो जाता था। यही प्रक्रिया बार-बार दुहराई जा रही थी। ऐसा प्रतीत हो रहा था मानो बेलुसोव की तश्तरी में मूलभूत सिद्धांतों को न मानते हुए मिश्रण में रंगहीन व पीले रंग के दोलन हो रहे हों।
इस शोधकार्य पर बेलुसोव ने एक शोधपत्र लिखा और विज्ञान की जानीमानी शोध-पत्रिकाओं में प्रकाशन हेतु भेज दिया, किन्तु दुर्भाग्यवश उसके अवलोकन इतने हैरतअंगेज़ थे कि शोधपत्र को प्रकाशन हेतु स्वीकार नहीं किया गया। इस घटना से बेलुसोव को इतना अधिक सदमा पहुंचा कि उसने विज्ञान विषय से ही सन्यास ले लिया।
बहरहाल इत्तफाक कुछ ऐसा हुआ कि कुछ साल बाद रूस के एक और उत्साही नौजवान वैज्ञानिक एस. सी. श्लोन की जैव-रसायनों की आवर्ती क्रियाओं में दिलचस्पी जागी। उन्होंने बेलुसोव से संपर्क किया और उससे शोधकार्य आगे बढ़ाने का आग्रह किया। लेकिन बेलुसोव अपने फैसले से टस-से-मस न हुआ, परन्तु उसने श्लोन को अपने शोधकार्य की जानकारी दी। साथ ही अपना शोधपत्र शोधपत्रिकाओं में प्रकाशित करने के लिए मंजूरी भी दे दी। सन् 1957 में बेलुसोव का शोधपत्र श्लोन के शोध-संस्थान की पत्रिका में प्रकाशित हुआ, परन्तु रूस के बाहर किसी को भी इस रिसर्च की जानकारी नहीं थी।
श्लोन के मार्गदर्शन में उसके एक विद्यार्थी, अनातोल झाबोटिन्स्की ने बेलुसोव की आवर्ती रासायनिक क्रियाओं का गहन अध्ययन किया। उसने बताया कि एक बंद प्रणाली में भी दोलन संभव होते हैं और कालांतर में रासायनिक क्रिया पूरी हो जाती है। इस तरह यहां कुदरत के किसी भी नियम-कायदे को नहीं तोड़ा जा रहा है। आवर्ती रासायनिक क्रियाओं के अनेक उदाहरण आज हमें मालूम हैं। रसायन विज्ञान की भाषा में इन क्रियाओं को बेलुसोव-झाबोटिन्स्की क्रियाएं अथवा संक्षिप्त में बी-जेड अभिक्रियाएं कहा जाता है।
ऐसी ही एक बी-ज़ेड क्रिया हमने प्रयोगशाला में आसानी से मिल सकने वाले रसायनों की मदद से करके देखी। इसे आप भी स्कूल की प्रयोगशाला में करके देख सकते हैं।
रंगों का दोलनः तश्तरी में
ऐसी ही एक बी-जेड अभिक्रिया के बारे में वर्ष 1974 की साइन्टिफिक अमेरिकन नाम की विज्ञान पत्रिका में हमने पढ़ा था। शोधछात्र आर्थर विनफ्री द्वारा इस क्रिया का विस्तृत वर्णन दिया गया था। इस प्रयोग में इस्तेमाल किए गए सभी रसायन सरलता से उपलब्ध हो जाते हैं, अतः हमने भी अपनी प्रयोगशाला में इस प्रक्रिया को दोहराने का सोचा। हमने न केवल रंगों के दोलनों का अवलोकन किया बल्कि तश्तरी में निश्चित अंतराल से उभरने वाली रंगों की छटाओं को कैमरे में कैद करने का भी प्रयास किया। मिश्रण में विभिन्न रसायनों की तुलनात्मक सान्द्रता को बदलने तथा सुक्ष्म मात्रा में नए पदार्थों को मिलाने पर रंगों के दोलनों पर होने वाले प्रभावों का भी हमने अध्ययन किया। मिश्रण को स्थिर रखने पर भी रसायनों की तुलनात्मक सान्द्रता में स्थानीय भिन्नता (local variation) के कारण मिश्रण के अलग-अलग हिस्सों में अलग-अलग रंगों को उभरते हुए देखा जा सकता था। तश्तरी में रंगों के विभिन्न पैटर्न को बनते बिगड़ते देखना एक रोचक अनुभव था। आप भी अपनी प्रयोगशाला में इस प्रयोग को दोहराकर देख सकते हैं। इसके लिए ज़रूरी सामान इस तरह से है।
सांद्र सल्फ्यूरिक अम्ल -- 2 मिली
सोडियम ब्रोमेट (NaBrO3) -- 5 मिग्रा
सोडियम ब्रोमाइड (NaBr) -- 1 ग्राम
मैलोनिक अम्ल -- 1 ग्राम
0.025 M फेरोईन सूचक -- 1 मिली
कांच की तश्तरी, बीकर, छड़ . . . .
आसुत जल
प्रयोग की शुरुआत करते हुए सबसे पहले 67 मि.ली. आसुत जल में 2 मि.ली. सान्द्र सल्फ्यूरिक अम्ल धीरे-धीरे सावधानी से मिलाना है। इसके बाद इस विलयन में 5 मि.ग्रा. सोडियम ब्रोमेट घोलें। और फिर इस में से 6 मि.ली. विलयन कांच की एक तश्तरी में निकाल लें।
अब एक और बीकर में 10 मिली, आसुत जल में 1 ग्राम सोडियम ब्रोमाइड घोलें। इस घोल में से 0.5 मि.ली. निकालकर पहले वाली कांच की तश्तरी में मिला दें।
फिर 10 मि.ली. आसुत जल में 1 ग्राम मैलोनिक अम्ल घोलकर इस घोल में से 1 मि.ली. को पहले वाली तश्तरी में मिलाना है। इसे मिलाते ही मिनट भर में आप पाएंगे कि तश्तरी में घोल का रंग पहले नारंगी और बाद में रंगहीन हो जाता है।
अब आखिरी चरण में इस तश्तरी में 1 मिली, फेरोइन सूचक मिलाकर मिश्रण को कांच की छड़ से हिलाइए। आप देखेंगे कि मिश्रण में बारी-बारी से लाल और नीले रंग उभर रहे हैं।
इस प्रयोग को पूरी कामयाबी के के साथ करना हो तो कुछ एहतियात बरतना ज़रूरी है मसलन इस्तेमाल की जाने वाली कांच की समस्त सामग्री अच्छी तरह धुली हो व सभी रसायन शुद्ध हों। कोशिश कीजिए कि कांच के सामान या किसी भी रसायन को हाथ से न छुएं क्योंकि हमारे पसीने में मौजूद क्लोराइड आयन की वजह से रंगों के दोलन में रुकावट पैदा हो सकती है। क्यों होते हैं रंगों के दोलन?
क्यों होते हैं रंगों के दोलन?
उपरोक्त क्रिया में ब्रोमेट, ब्रोमाइड व मैलोनिक अम्ल प्रमुख किरदार हैं। आयरन के एक संकुल यौगिक, फेरोइन का सूचक के रूप में प्रयोग किया गया
बी-ज़ेड कैमरे की कैद में : रंगों के दोलन को देखने के लिए फेरोइन सूचक मिलाने के बाद, कैमरे को एकदम तैयार रखकर, पहले तीन फोटोग्राफ 2-2 सेकेंड के अंतराल से खींचे गए तथा चौथा फोटो 18 सेकेंड के बाद खींचा गया है। बाद के दोनों फोटो फिर में 2-2 सेकंड के अंतराल से खींचे गए हैं। फोटो क्रमांक 1 में तश्तरी में लाल रंग गाढ़ा है तो 3 में नीला रंग दिखने लगा है और 4 में नीला रंग गाढ़ा है। 6 में एक बार फिर लाल रंग काफी स्पष्ट रूप से दिखने लगा है। रंगों के नज़ारे का मज़ा लेने के लिए पीछे का कवर देखें।
है। इसके ज़रिए क्रिया की प्रगति पर नज़र रखी जा सकती है। यह एक रेडॉक्स सूचक है जिसमें उपस्थित आयरन फेरस (Fe2+) अवस्था में लाल तथा फेरिक (Fe3+) अवस्था में नीला रंग प्रदर्शित करता है।
रंग परिवर्तन द्वारा यह माध्यम की अपचायक या ऑक्सीकारक प्रकृति की पहचान कराता है। किसी रासायनिक मिश्रण में यदि अपचयन व ऑक्सीकरण (रिडक्शन व ऑक्सीडेशन) के लिए अनुकूल स्थितियां बारी-बारी से पैदा होती हैं तो फेरोइन सूचक की उपस्थिति में रासायनिक क्रिया लाल व नीले रंग के बीच दोलित होती हुई प्रतीत होती है।
ब्रोमेट, ब्रोमाइड व मैलोनिक अम्ल के बीच क्रिया से ऐसी ही स्थितियां निर्मित होती हैं। इस क्रिया में ब्रोमाइड आयनों की भूमिका महत्वपूर्ण होती है। ब्रोमाइड आयनों की सान्द्रता बारी-बारी घटती बढ़ती रहती है, इसी के साथ मिश्रण में नीले व लाल रंग की लहरें उत्पन्न होती हैं।
प्रारंभ में आयरन फेरस अवस्था में होने के कारण मिश्रण का रंग लाल होता है। ब्रोमेट, ब्रोमाइड व मैलोनिक अम्ल के बीच क्रिया के फलस्वरूप जैसे-जैसे मिश्रण में ब्रोमोमैलोनेट बनता जाता है, ब्रोमाइड आयनों की सान्द्रता घटती जाती है। सूचक के ऑक्सीकरण के लिए यह अनुकूल स्थिति है, ब्रोमाइड आयनों की अनुपस्थिति में ब्रोमेट आयन सूचक को फेरस अवस्था से फेरिक में ऑक्सीकृत करते हैं। क्रिया में उत्पन्न ब्रोमोमैलोनेट भी फेरस को फेरिक में बदलता है। अतः मिश्रण का रंग लाल से नीला हो जाता है।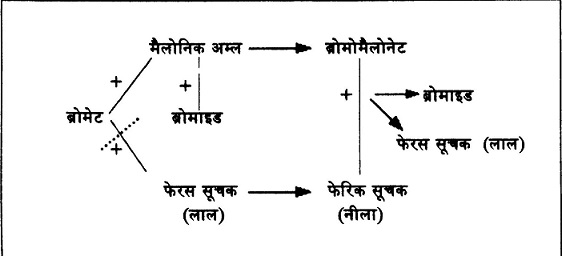
परन्तु ऑक्सीकरण की उपरोक्त क्रियाओं के दौरान मिश्रण में पुनः ब्रोमाइड आयन उत्पन्न होने लगते हैं। फलस्वरूप ब्रोमाइड आयनों की सान्द्रता बढ़ती है। अत: फेरिक का परिवर्तन फेरस में होने लगता है और मिश्रण का रंग नीले से लाल हो जाता है।
लगभग एक घण्टे तक फेरस और फेरिक अवस्थाओं के बीच दोलन जारी रहते हैं परन्तु समय के साथ धीरे-धीरे दोलनों का ह्रास होता है। अंततः रासायनिक क्रिया किसी एक दिशा में अग्रसर होती है और पूर्णत्व को प्राप्त करती है। इस अवस्था में मिश्रण स्थायी रूप से लाल अथवा नीला हो जाता है। अंतिम रूप से रासायनिक क्रिया किस दिशा में अग्रसर होगी, यह कारकों की शुरुआती सान्द्रता पर निर्भर करता है। विपरीत रासायनिक क्रियाओं के बीच दोलनों के बावजूद अंततः क्रिया का पूर्णत्व की ओर बढ़ना यह साबित करता है कि बी-जेड क्रियाओं में किसी भी मूलभूत नियम का उल्लंघन नहीं होता है।
इस प्रयोग में कई तरह के बदलाव किए जा सकते हैं जैसे: सल्फ्यूरिक अम्ल के स्थान पर सोडियम बाइसल्फेट का प्रयोग किया जा सकता है। इसी प्रकार से सोडियम ब्रोमेट में ब्रोमाइड के स्थान पर पोटेशियम लवणों का उपयोग कर सकते हैं। मिश्रण में सोडियम ब्रोमाइड की मात्रा कम करने पर आंदोलन की आवृत्ति बढ़ती है, अर्थात रंग परिवर्तन जल्दी-जल्दी होता है। यदि मैलोनिक अम्ल के स्थान पर अन्य अम्लों, जैसे डाइब्रोमो या मोनोब्रोमो मैलोनिक अम्ल, साइट्रिक अम्ल, मैलेइक अम्ल अथवा मैलिक अम्ल, का प्रयोग किया जाता है तो दोलन प्रारंभ होने में काफी समय लग जाता है। कभी-कभी तो आधे घंटे से भी ज्यादा समय लगता है दोलन शुरू होने में।
बी-ज़ेड क्रियाओं में रंग परिवर्तन को अधिक सुस्पष्ट बनाने के लिए अन्य रसायनों का भी उपयोग किया जाता है। उपरोक्त प्रयोग में फेरोइन सूचक की मात्रा घटाकर यदि कुछ बूंदें 0.1M सेरिक सल्फेट की मिलाई जाती हैं तो (Fe++--Fe+++) दोलनों के साथ-साथ मिश्रण में (Ce3+--Ce4+) दोलन भी निर्मित होते हैं, फलस्वरूप लाल व
|
तीन रंगों वाली बी-जेड क्रिया आवश्यक सामग्री: |
नीले रंग में अधिक गहरापन आ जाता है। फेरोइन तथा सेरिक सल्फेट की परस्पर सापेक्ष सान्द्रता के अनुसार मिश्रण में नीली-जामुनी अथवा लाल-हरी लहरों के दोलन देखे जा सकते हैं।
बेलुसोव ने अपने प्रयोग में सूचक के रूप में मात्र सेरिक सल्फेट का उपयोग किया था। इस सूचक की उपस्थिति में मिश्रण रंगहीन व पीले रंग के बीच दोलन करता है। इन रंगों में फर्क काफी कम होता है इसलिए यह रंग-परिवर्तन पहचान पाना थोड़ा मुश्किल होता है। वहीं लाल और नीले रंग में अंतर कर पाना अपेक्षाकृत आसान होता है। अतः बी-ज़ेड क्रियाओं के प्रदर्शन में प्रायः फेरस-फेरिक दोलनों को ही अपनाया जाता है। सेरियम सल्फेट और फेरोइन की मात्राओं में थोड़ा फर्क करने पर नीला-जामुनी या हरा-लाल दोलन भी देखने को मिलता है।
हमने अपने प्रयोग में फेरोइन और सेरिक सल्फेट के मिश्रण को बतौर सूचक इस्तेमाल किया। इसी तरह
| मि.ली. परक्लोरिक एसिड सावधानी से मिलाइए। और आसुत जल मिलाकर आयतन 100 मिली, करिए। 4. 0.150 M मैलोनिक एसिड घोलः 50 मि.ली. आसुत जल में 1.5 ग्राम मैलोनिक एसिड घोलकर आयतन को 100 मि.ली. बनाइए। 5. 0.0201 M मैंगनीज़ सल्फेट घोलः 50 मि.ली. आसुत जल में 0.3 ग्राम मैंगनीज़ सल्फेट घोलकर आयतन 100 मि.ली. बनाइए। 6. 0.03 प्रतिशत स्टार्च सूचक घोलः 1000 मि.ली. आसुत जल में 0.3 ग्राम स्टार्च घोलिए। प्रयोग कैसे करें: कांच के तीन बीकरों पर क्रमशः A, B, C लेबल लगाइए। बीकर A इस बीकर में हाइड्रोजन पेरॉक्साइड का घोल रखिए। बीकर B पोटेशियम आयोडाइड व परक्लोरिक एसिड के घोल मिलाकर इस बीकर में रख लें। बीकर C मैलोनिक एसिड ब मैंगनीज़ सल्फेट के घोल मिलाकर इस बीकर में रखें। इस मिश्रण में सूचक की कुछ बूंदें मिलाइए। कांच की एक तश्तरी में उपरोक्त तीनों घोल A, B, C की बराबर-बराबर मात्राएं मिलाइए। मिश्रण में बी-ज़ेड क्रिया शुरू होने पर बारी-बारी से रंगहीन, सुनहरी और नीली लहरें उत्पन्न होंगी - यानी बन गया तिरंगा बी-ज़ेड रिएक्शन। |
सोडियम ब्रोमेट के एवज में पोटेशियम ब्रोमेट को लिया। विनफ्री ने अपने लेख में इस प्रयोग के संदर्भ में कुछ बदलाव सुझाए थे। हमने भी मूल मिश्रण में ब्रोमाइड का इस्तेमाल ही नहीं किया। परन्तु जैसा कि पहले देखा था कि तश्तरी में क्रिया करवाने में ब्रोमाइड एक खास अभिकारक है। दरअसल ब्रोमोमैलोनेट द्वारा फेरस सूचक को फेरिक सूचक में परिवर्तित करते समय वह इस मिश्रण में बनता है। हमारे द्वारा किए बदलाव का एक फायदा तुरंत दिखाई दिया कि मिश्रण में ब्रोमाइड कम होने की वजह से रंगों के दोलन थोड़े तेज़ी से होने लगे।
बी-ज़ेड क्रिया और फीडबैक तंत्र
बी-जेड क्रिया स्वयं के अभिकारक स्वयं निर्मित करती है (Autocatalysis)। जिस क्रिया की हमने पहले चर्चा की उसमें ब्रोमाइड क्रिया के फलस्वरूप बनने वाले उत्पादों में से एक है। यह क्रिया धनात्मक फीडबैक (Positive Feedback) का एक उदाहरण है। जब
|
बी-जेड अभिक्रिया के उपयोग जापान में तरल खाद्य पदार्थों को गाढ़ा बनाने के लिए एक बहुलक, आइसोप्रोपाइल एक्रिलएमाइड का उपयोग किया जाता है। इस बहुलक (पोलिमर) की एक विशेषता है। रुथेनियम धातु के एक संकुल यौगिक को इस बहुलक में मिलाने पर यह बी-ज़ेड क्रिया प्रदर्शित करता है। रूथेनियम की ऑक्सीकरण अवस्थाओं में दोलन के साथ ही बहुलक के रंग व आकार में भी परिवर्तन होता है। बहुलक का रंग नारंगी से हरा होने पर आकार बढ़ता है (प्रसार) और हरे से नारंगी होने पर घटता है (संकुचन)। हर छः मिनट के अंतराल पर यह परिवर्तन होते रहते हैं। |
किसी प्रक्रिया के फलस्वरूप प्राप्त परिणाम प्रक्रिया के कारकों को प्रभावित करता है तब इस घटना को फीडबैक कहा जाता है। हमारे रोज़मर्रा के आर्थिक व्यवहार में फीडबैक के अनेक उदाहरण मिलते हैं।
यदि किसी वर्ष प्याज़ की पैदावार कम होती है, तो प्याज़ के भाव आसमान छूने लगते हैं। इससे उत्साहित होकर अगले वर्ष अधिक संख्या में किसान प्याज़ के उत्पादन की ओर आकर्षित होते हैं। परिणामस्वरूप प्याज़ की पैदावार बढ़ती है परन्तु भाब में गिरावट आ जाती है। इस संदर्भ में हम कह सकते हैं कि प्याज़ का भाव परिणाम है और प्याज़ की पैदावार कारक।
फीडबैक धनात्मक अथवा ऋणात्मक दोनों तरह का हो सकता है। धनात्मक फीडबैक में परिणाम के प्रभाव से कारकों की ऊर्जा बढ़ती है, जबकि ऋणात्मक फीडबैक में ऊर्जा कम होती है। बढ़े हुए भाव की वजह से अगले वर्ष प्याज़ की पैदावार में बढ़ोत्तरी होना, यह धनात्मक फीडबैक है। यदि परस्पर सहमति से किसानों द्वारा सही योजना बनाई जाती और प्याज़ के बड़े हुए भाव को कायम रखने के लिए अगले वर्ष कम पैदावार की जाती, तब यह ऋणात्मक फीडबैक का उदाहरण होता। इस लेख के प्रारंभ में घास, हिरण और सिंहों की जिस जैविक प्रणाली का उल्लेख किया गया है उसमें भी फीडबैक के महत्व को नकारा नहीं जा सकता। वास्तव में 'जैविक प्रणालियों में फीडबैक' अपने आप में एक स्वतंत्र लेख का विषय हो सकता है।
बी-जेड और नाभिकीय श्रृंखला
नाभिकीय श्रृंखला अभिक्रिया (Nuclear Chain Reaction) और बी-ज़ेड क्रियाओं को इस दृष्टि से एक ही समूह में रखा जा सकता है कि दोनों क्रियाएं स्वयं के कारक स्वयं निर्माण करती हैं और दोनों में धनात्मक फीडबैक देखा जाता है। परन्तु दोनों क्रियाओं में मूलभूत अंतर होता है। नाभिकीय क्रिया में यूरेनियम परमाणु के विभाजन स्वरूप न्यूट्रोन उत्पन्न होते हैं; ये न्यूट्रोन अन्य यूरेनियम परमाणुओं के विभाजन को प्रेरित करते हैं और क्रिया निरंतर आगे बढ़ती जाती है। इस क्रिया को यदि बाहर से नियंत्रित न किया जाए तो ये महाविनाशकारी विस्फोट का कारण बनती है (जैसे परमाणु बम में)। क्रिया को बाहर से नियंत्रित करने के लिए न्यूट्रोन्स की संख्या को सीमित करना होता है। न्यूट्रोन अवशोषी पदार्थों का उपयोग करके इस क्रिया को नियंत्रित किया जाता है, जैसे एक परमाणु रिएक्टर में।
|
फीडबैक कंट्रोल मेकेनिज्म किसी प्रक्रिया के परिणाम के द्वारा प्रक्रिया को नियंत्रित करने के लिए फीडबैक मेकेनिज्म का उपयोग किया जा सकता है। बहुत से इलेक्ट्रॉनिक उपकरण इसी सिद्धांत पर कार्य करते हैं। इसका एक उदाहरण रेफ्रिजरेटर है। रेफ्रिजरेटर का स्विच सतत चालू स्थिति में होते हुए भी रेफ्रिजरेटर द्वारा विद्युत का सतत उपयोग नहीं किया जाता है। रेफ्रिजरेटर में लगी फीडबैक कंट्रोल की युक्ति के कारण विद्युत प्रवाह के बारी-बारी से रुकने व चालू होने की प्रक्रिया निरंतर जारी रहती है। रेफ्रिजरेटर में लगे एक इलेक्ट्रॉनिक उपकरण के द्वारा अंदर के ताप का सतत मापन किया जाता है। तापमान एक निश्चित बिन्दु तक गिरने यानी कम होने पर विद्युत पथ स्वतः टूट जाता है। और विद्युत प्रवाह रुक जाता है। रेफ्रिजरेटर के तापरोधी आवरण के कारण एक लंबे समय तक अंदर का तापमान स्थिर बना रहता है, बाद में धीरे-धीरे बढ़ने लगता है। तापमान एक निश्चित बिन्दु तक बढ़ने पर विद्युत पथ स्वतः पूर्ण हो जाता है, विद्युत प्रवाह चालू हो जाता है और रेफ्रिजरेटर पुनः ठण्डा करने लगता है। इस युक्ति के ज़रिए तापमान को स्थिर रखने की प्रक्रिया में विद्युत व्यय भी कम होता है। |
नाभिकीय श्रृंखला क्रिया के विपरीत बी-जेड क्रियाएं अनियंत्रित नहीं होती हैं। आंतरिक मेकेनिज्म द्वारा बी-जेड क्रिया स्वयं को नियंत्रित करती है। इस क्रिया में परस्पर स्पर्धा करने वाली दो रासायनिक क्रियाएं साथ-साथ चलती हैं। और एक दूसरे को नियंत्रण में रखती हैं।
बी-ज़ेड क्रिया का महत्व
रंग परिवर्तन बी-जेड क्रिया की प्रमुख विशेषता है और रसायन शास्त्र को मनोरंजक बनाने के लिए इस विशेषता का उपयोग किया जा सकता है। वैज्ञानिक शोध की दृष्टि से भी बी-जेड क्रियाओं के अध्ययन का महत्व है। इन क्रियाओं में रंगों के विशिष्ट पैटर्न निर्मित होते हैं, समय व स्थान के अनुसार पैटर्न में परिवर्तन होते हैं। इसी प्रकार से ज़ेब्रा के शरीर की धारियों से लेकर शेयर बाज़ार की तेजी-मंदी तक विभिन्न प्रणालियों में विशिष्ट पैटर्न देखे जा सकते हैं। शोधकर्ताओं का मत है कि एक-दूसरे से सर्वथा भिन्न इन प्रणालियों में विशिष्ट पैटर्न के निर्माण के पीछे फीडबैक मेकेनिज़्म ही काम कर रहा होता है।
इन सभी प्रणालियों में बी-जेड प्रणाली अपेक्षाकृत कम जटिल है, इसका अध्ययन करना आसान है। वैज्ञानिकों को विश्वास है कि बी-जेड क्रियाओं के अध्ययन के आधार पर अन्य क्षेत्रों जैसे--- जैविक, आर्थिक, सामाजिक आदि की प्रणालियों में पैटर्न निर्माण के रहस्य को उजागर किया जा सकता है।
अभय कर्नाटकी: पुणे विश्वविद्यालय में मेटिरियल साइंस के विद्यार्थी।
अरुण बनपूरकर: पुणे विश्वविद्यालय में मेटिरियल साइंस विभाग में व्याख्याता हैं। साथ ही रासायनिक प्रणाली की विशेष आकृतियों पर शोधकार्य किया है।
प्रियदर्शिनी कर्वे: सिंहगढ़ कॉलेज ऑफ इंजीनियरिंग, पणे में व्याख्याता है। विज्ञान लेखन में रुचि। पुणे से प्रकाशित होने वाली मराठी संदर्भ के संपादन मंडल की सदस्य हैं।
हिन्दी अनुवादः सुधा हर्डीकरः रसायन-शास्त्र का अध्ययन व अध्यापन किया है। उच्च शिक्षा विभाग से सेवा निवृत। होशंगाबाद में रहती हैं।
यह लेख मराठी संदर्भ के अंक 11, जून-जुलाई 2001, से साभार।
इस विषय में और जानकारी के लिए सायंटिफिक अमेरिकन पत्रिका के जून 1974 व जुलाई 1978 अंक देखें।