हमारे आसपास की चीज़ें परमाणुओं से बनी होती हैं, लेकिन ये परमाणु अलग-अलग नहीं तैरते रहते हैं। वे आम तौर पर दूसरे परमाणुओं (या परमाणुओं के समूहों) के साथ जुड़ जाया करते हैं। उदाहरण के लिए, परमाणु मज़बूत बंधनों से जुड़े हो सकते हैं और अणुओं या क्रिस्टल में व्यवस्थित हो सकते हैं या वे दूसरे परमाणुओं के साथ, जिनसे वे टकराते हैं, अस्थायी, कमज़ोर बंधन बना सकते हैं । अणुओं को एक साथ रखने वाले मज़बूत बंधन और अस्थायी कनेक्शन बनाने वाले कमज़ोर बंधन दोनों ही हमारे जीवन के अस्तित्व के लिए महत्वपूर्ण हैं।
आखिर रासायनिक बंधन क्यों बनते हैं? दरअसल परमाणु सबसे स्थिर (सबसे कम ऊर्जा) अवस्था तक पहुंचने की कोशिश करते हैं। कई परमाणु इसलिए स्थिर होते हैं क्योंकि उनके इलेक्ट्रॉन विन्यास में सबसे बाहरी खोल इलेक्ट्रॉनों से परिपूर्ण होते हैं (अधिकांश परमाणुओं के संदर्भ में यह स्थिति वह होती है जब सबसे बाहरी खोल में 8 इलेक्ट्रॉन हों, या कुछ मामलों में 2 इलेक्ट्रॉन से भी काम चल जाता है।) यदि परमाणुओं में यह व्यवस्था नहीं है, तो उनमें अन्य परमाणुओं से बंध बनाकर यह स्थिति प्राप्त करने की प्रवृत्ति होती है। ऐसा अतिरिक्त इलेक्ट्रॉन प्राप्त करके, गंवाकर या साझा करके किया जाता है। परमाणुओं के बीच बंध मूलत: उनके बीच उपस्थित इलेक्ट्रॉन के प्रति नाभिकों के आकर्षण का परिणाम होते हैं। इस लिहाज़ से बंध तीन प्रकार के हो सकते हैं।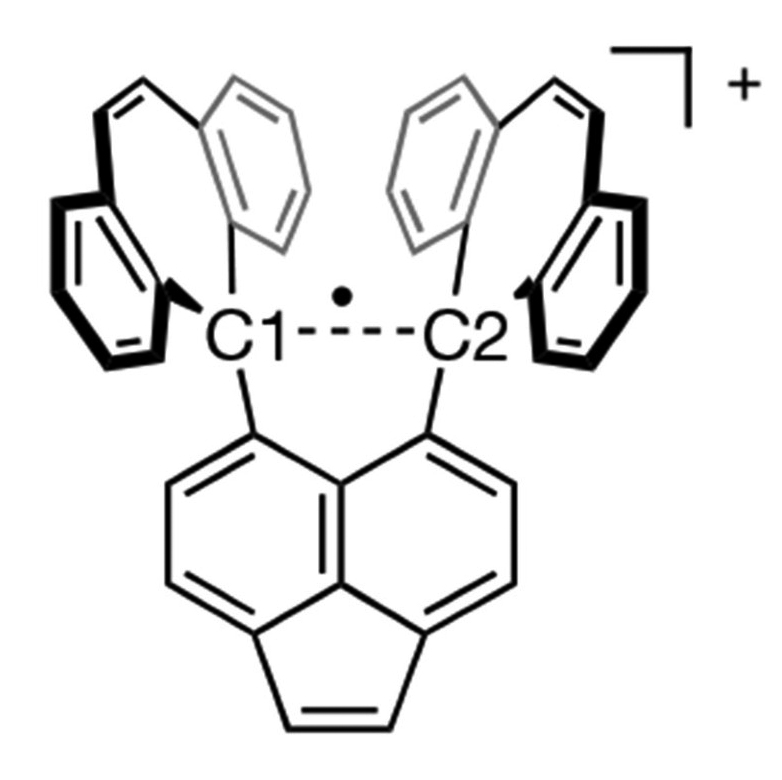
आयनिक बंधन में परमाणु इलेक्ट्रान को पूरी तरह से प्राप्त करके या गंवाकर आयन बनता है। जब इलेक्ट्रॉन प्राप्त किया जाता है तो ऋणायन बनता है और इलेक्ट्रॉन गंवाने के परिणामस्वरूप धनायन बनता है। आयनिक बंधन इन्हीं विपरीत आवेशों वाले आयनों के बीच आकर्षण होता है। उदाहरण के लिए, धन-आवेशित सोडियम आयन और ऋण-आवेशित क्लोराइड आयन एक दूसरे को आकर्षित करके सोडियम क्लोराइड या टेबल सॉल्ट बनाते हैं।
सहसंयोजी बंध में परमाणु इलेक्ट्रॉनों को पूरी तरह से प्राप्त करने या खोने की बजाय साझा करते हैं। इसलिए अणुओं में सहसंयोजी बंधों की संख्या इस बात पर निर्भर करेगी कि किन्हीं दो परमाणुओं के बीच कितने इलेक्ट्रॉन साझा किए जा रहे हैं। यदि वे तीन-तीन इलेक्ट्रॉन साझा करते हैं तो वह तिहरा (ट्रिपल) बंध बनेगा, जैसे कि नाइट्रोजन के अणु में होता है। यदि दो इलेक्ट्रॉन साझा हो रहे हों तो दोहरा (डबल) बंध बनेगा, उदाहरण के तौर पर ऑक्सीजन का अणु देखा जा सकता है। इसी तरह से 1-1 इलेक्ट्रॉन साझा हो रहे हों तो यह एकल (सिंगल) बंध बनाएगा। जैसे हाइड्रोजन में। ऐसे बंध अलग-अलग किस्म के परमाणुओं के बीच भी बन सकते हैं। जैसे नाइट्रोजन और ऑक्सीजन के बीच या हाइड्रोजन और ऑक्सीजन के बीच। वैसे नोबेल विजेता रसायनज्ञ लायनस पौलिंग ने 1931 में सुझाया था कि सहबंध मात्र 1 इलेक्ट्रॉन की साझेदारी से भी बन सकते हैं। तब से कई ऐसे 1 इलेक्ट्रॉन की साझेदारी वाले सह-बंध देखे जा चुके हैं।
इन दो के अलावा एक तीसरे किस्म का बंध भी बनता है - उप-सहसंयोजी बंध। लेकिन यहां हम सहसंयोजी बंधों पर ध्यान देंगे।
रसायनज्ञ जानते हैं कि परमाणु विभिन्न तरीकों से आपस में जुड़ा करते हैं और जुड़ाव की प्रकृति का रसायन समझने के लिए रसायनज्ञ सतत अध्ययन करते रहते हैं। इसके लिए रसायनज्ञ नए अणुओं का संश्लेषण भी करते हैं और प्रकृति में मौजूद अणुओं के क्रिस्टल को भी अपने अध्ययन में शामिल करते हैं। हर तरह की परिस्थिति में इन अणुओं की बनावट और इनमें परमाणुओं की जमावट का लगातार अध्ययन करते हुए यह जानने की कोशिश करते हैं कि आखिर रासायनिक बंध क्या है (यानी कौन-सी शक्ति परमाणुओं को आपस में बांधती है) और इसकी प्रकृति क्या है?
इस सतत अध्ययन का नतीजा एकल इलेक्ट्रॉन सहसंयोजी बंध है। आम तौर पर सहबंध के मामले में यह मान्यता रही है कि बंध में शामिल दोनों परमाणु कम से कम एक-एक इलेक्ट्रॉन साझा करेंगे। यानी कुल कम से कम दो इलेक्ट्रॉन साझा होंगे। लेकिन फिर 1998 में, सीएनआरएस के वाय. कैनेक की टीम ने दो फॉस्फोरस परमाणुओं के बीच एक एकल-इलेक्ट्रॉन बंध देखा। यह बंध एक बेंज़ीन अणु में दो फॉस्फोरस परमाणुओं के बीच देखा गया था। इस बंध में दोनों परमाणुओं के बीच एक ही इलेक्ट्रॉन साझा हुआ था। अलबत्ता, यह बंध दुर्बल स्वभाव का था। कैलिफोर्निया इंस्टीट्यूट ऑफ टेक्नॉलॉजी के शोधकर्ता मार्क एटिएन मोरेट के शोध समूह ने 2013 में तांबे और बोरॉन के बीच ऐसा ही एकल इलेक्ट्रॉन बंध पाया था।
लेकिन अब तक दो कार्बन परमाणुओं के बीच ऐसा एकल इलेक्ट्रॉन सहसंयोजी बंध नहीं देखा गया था। रसायनज्ञों ने इन सभी अणुओं का अध्ययन करते हुए पाया कि ये असामान्य बंध परमाणुओं के बीच थोड़े समय के लिए ही बन सकते हैं जो रासायानिक अभिक्रियाओं के दौरान मध्यवर्ती संरचनाओं में बनते हैं। ये बंध अस्थिर होने के कारण आसानी से टूट जाएंगे इसलिए इन अस्थिर बंधों को देखने के लिए, ऐसे बंध वाले यौगिक को स्थिर करना होगा। हाल तक कार्बन परमाणुओं के बीच ऐसे एकल इलेक्ट्रॉन बंध नहीं देखे जा सके थे।
कार्बन के विशिष्ट गुणों के चलते कार्बन रसायन विज्ञान की अपनी शाखा है जिसे कार्बनिक रसायन कहा जाता है और कार्बन के यौगिक जीवन के आधार भी हैं। कार्बन गुणों में विशेष है। कार्बन में यह क्षमता है कि वह केवल अपने ही परमाणुओं की लंबी-लंबी शृंखलाएं बना सकता है। कार्बन के एक दर्जन या उससे ज़्यादा एलोट्रोप (अपररूप) होते हैं जिनमें कार्बन परमाणुओं की जमावट के कारण एकदम अलग-अलग गुण पाए जाते हैं। इनमें ग्रेफाइट, ग्रेफीन, हीरा, एस्बेस्टॉस और बकीबॉल शामिल हैं।
और अब, कार्बन की उपलब्धियों में एक और उपलब्धि जुड़ गई है - एकल इलेक्ट्रॉन सहसंयोजी बंध बनाने की क्षमता। जापान के होक्काइडो विश्वविद्यालय के चार वैज्ञानिकों की शोध टीम हेक्साफिनाइलएथेन के एक व्युत्पन्न के बारे में अध्ययन कर रही है। वे इस बाबत शोध कर रहे थे कि जब हेक्साफिनाइलएथेन का ऑक्सीकरण आयोडीन की उपस्थिति में किया जाता है तो क्या होता है। 25 सितंबर 2024 के दिन इस टीम को ऐसा अवलोकन करने को मिला जो वास्तव में 93 साल पहले नोबेल पुरस्कार विजेता लायनस पॉलिंग द्वारा सुझाया गया था। इस तरह वैज्ञानिकों ने दो कार्बन परमाणुओं के बीच एकल इलेक्ट्रॉन सहसंयोजी बंध के एक सदी पुराने सपने को साकार किया है।
इस शोध टीम को हेक्साफिनाइलएथेन के एक व्युत्पन्न यौगिक में कार्बन परमाणुओं के बीच एक स्थिर एकल-इलेक्ट्रॉन सहसंयोजी बंध मिला। एकल बंध के बारे में बेहतर तरीके से जानने के लिए जरूरी था कि एक ऐसा यौगिक बनाया जाए जो एकल बंध को स्थिर कर सके। इसे प्राप्त करने के लिए, शोध टीम द्वारा हेक्साफिनाइलएथेन के ऐसे व्युत्पन्न अणु का चुनाव किया गया जिसमें दो कार्बन परमाणुओं के बीच एक बहुत लम्बा युग्मित-इलेक्ट्रॉन वाला सहसंयोजी बंध था। उन्होंने आयोडीन का उपयोग करके हेक्साफिनाइलएथेन के व्युत्पन्न को ऑक्सीकृत किया जिससे एक बैंगनी रंग का क्रिस्टल मिला। एक्स-रे क्रिस्टलोग्राफी की मदद से जांच करने पर उन्होंने देखा कि दो कार्बन परमाणु एक एकल-इलेक्ट्रॉन सहसंयोजी बंध के कारण काफी करीब आ गए थे। रमन स्पेक्ट्रोस्कोपी ने एकल इलेक्ट्रॉन कार्बन-कार्बन बंध की उपस्थिति की पुष्टि की। दरअसल क्रिस्टल के अणु का केंद्रीय कार्बन-कार्बन बंध खिंच जाने से यह एक इलेक्ट्रॉन खोने के लिए अतिसंवेदनशील हो जाता है और इस तरह एकल-इलेक्ट्रॉन बंध बनता है।
टोक्यो विश्वविद्यालय के रसायनज्ञ ताकुया शिमाजिरी, जो कार्बन बॉन्डिंग शोध टीम का हिस्सा थे, कहते हैं, “सहसंयोजी बंध रसायन विज्ञान में सबसे महत्वपूर्ण अवधारणाओं में से एक है, और नए प्रकार के रासायनिक बंधनों की खोज आशाजनक है।”
1931 में, रसायनज्ञ लायनस पॉलिंग ने जर्नल ऑफ दी अमेरिकन केमिकल सोसाइटी में कार्बन परमाणुओं की एक जोड़ी के बीच एकल इलेक्ट्रॉन सहसंयोजी की संभावना के बारे में लिखा था। पॉलिंग का सुझाव था कि एकल-इलेक्ट्रॉन सहसंयोजी बंध मौजूद हो सकते हैं, लेकिन वे सामान्य दो-इलेक्ट्रॉन सहसंयोजी बंधनों की तुलना में कमज़ोर होंगे।
मुझे उपरोक्त पर्चा खोजकर 1931 में लायनस पॉलिंग द्वारा दिए गए सुझाव को फिर से पढ़ने का मन कर रहा है। आखिर ऐसे कौन से अवलोकन थे जिसके कारण पॉलिंग के मन में यह विचार आया। मैं इस कोशिश में आगे बढ़ रही हूं। अगर आपको इस विषयवस्तु से सम्बंधित कुछ पाठ्य सामग्री मिले तो मुझे ज़रूर भेजिए। (स्रोत फीचर्स)
-
Srote - April 2025
- जन स्वास्थ्य अभियान के 25 वर्ष: उपलब्धियां और सीमाएं
- 20 सूत्रीय जन स्वास्थ्य चार्टर
- सबके लिए स्वास्थ्य हासिल करने ‘मिशन पॉसिबल’
- अनौपचारिक स्वास्थ्य सेवा प्रदाताओं की भूमिका
- नींद में मस्तिष्क खुद की सफाई करता है
- खरपतवारनाशी से शिशु स्वास्थ्य को खतरा
- बढ़ते तापमान का अदृश्य स्वास्थ्य संकट
- जीन संपादन कैंची का उपयोग
- महिलाओं, चींटी जैसे काम करो, पुरुषों जैसे व्यवहार करो लेकिन महिला बनी रहो!
- तंबाकू के विरुद्ध आवाज उठाने वाले वैज्ञानिकों पर संकट
- कृत्रिम बुद्धि की मदद से प्राचीन शिल्पों का जीर्णोद्धार
- कार्बन-कार्बन एकल इलेक्ट्रॉन बंध देखा गया
- दांतों ने उजागर किया स्तनपान का पैटर्न
- नई यादें बनने पर पुरानी यादें मिट क्यों नहीं जातीं?
- घटते बादलों से ग्लोबल वार्मिंग का खतरा
- प्राचीन रोम के लोगों ने सीसा प्रदूषण झेला है
- 1.5 डिग्री की तापमान वृद्धि की सीमा लांघी गई
- रैटलस्नेक एक-दूसरे के शल्क से पानी पीते हैं
- यह सांप निगल जाता है मुंह से कई गुना बड़ा शिकार
- समुद्री मकड़ियां खुद को रेत में क्यों दबाती हैं?
- वृक्ष मेंढकों की दिलचस्प छलांग
- कोरल भी चलते हैं, लेकिन घोंघों से भी धीमे
- जगमगाते कुकुरमुत्ते

